Большинство лекарственных средств назначают в виде пероральных препаратов или внесосудистых инъекций для лечения системных заболеваний. Следовательно, эти лекарства должны быть абсорбированы, чтобы транспортироваться к тканям-мишеням и вызывать их фармакологические действия.
Биодоступность играет ключевую роль в определении того, оказывает ли лекарство клинический эффект и как быстро он наступает.
Что такое биодоступность лекарств?
Биодоступность лекарственных средств – это количество активного вещества, которое достигло основного места действия в организме человека. Этот термин обозначает количество потерянных и сохраненных питательных или лекарственных веществ, которые необходимы для организма.
Распространенным средством определения биодоступности является измерение концентрации препарата в крови или моче через определенные промежутки времени. Врачи знают спектр биодоступности препаратов и рассчитывают дозировку для получения желаемой терапевтической концентрации лекарства.
Часто 2 термина, абсорбция и биодоступность, рассматриваются как синонимы, но между ними существует небольшая разница. Возможно, что лекарственные препараты будут быстро всасываться перорально из-за хорошей растворимости в липидах, но не будут обладать хорошей биодоступностью из-за обширной пресистемной потери.
Это относится к лекарству, потерянному между пероральным введением и первым появлением в системном кровообращении. Препарат должен пережить среду в желудочно-кишечном тракте, пересечь стенку кишки и затем пройти через воротную вену в печень.
Если молекула лекарства выживет на этом пути, она достигнет системного кровообращения. Метаболизм печени — самая большая проблема с увеличением доступности. Чтобы преодолеть слабую биодоступность, врачи увеличивают введенную дозу, изменяют фармацевтическую композицию или используют другой путь введения.
Типы биодоступности
Не все компании могут производить оригинальные лекарства, и не каждый потребитель может их себе позволить, поэтому необходимы качественные универсальные заменители активных веществ. Чтобы они соответствовали всем стандартам, необходимо проводить исследование биоэквивалентности.
Согласно определению ВОЗ, 2 препарата считаются биоэквивалентными, если они фармацевтически эквивалентны, имеют одинаковую биодоступность и при использовании в одинаковой дозе обеспечивают надлежащую эффективность и безопасность.
Понятие относительной биологической доступности
Биодоступность лекарственных средств — это доля вводимой дозы медицинского препарата, которая в неизменном виде попадает в кровоток. В медицинской практике чаще определяют относительную биодоступность. Стандартом измерения в этом случае является пероральная форма исследуемого препарата, которая хорошо изучена и успешно всасывается.

Относительную доступность препарата определяют при сравнительной оценке лекарственного средства, вводимого в стандартной лекарственной форме (стандартным может быть клинически доказанный препарат) и тестового лекарственного препарата.
Оба препарата должны быть введены одним и тем же путем. Вычисление относительной доступности необходимо в случае изменения технологии производства лекарственного средства, при изготовлении различных лекарственных форм. Относительная биодоступность выражается в процентах.
Понятие абсолютной биологической доступности
Абсолютную биодоступность можно рассчитать путем сравнения общего количества лекарственного средства, которое попадает в системный кровоток после ректального, перорального и других путей введения с общим количеством, которое достигает системного кровообращения после внутривенного введения.
Оно используется в качестве стандарта, эталона, для сравнения системной доступности лекарства, вводимого различными путями.
Когда лекарство вводится внутривенно, введенная доза напрямую поступает в системный кровоток, она не будет сталкиваться с барьерами поглощения, и, следовательно, считается, что она полностью (на 100%) биодоступна. Абсолютная биодоступность также выражается в процентах.
Факторы, влияющие на биодоступность лекарств
Есть много факторов, которые влияют на биодоступность:
- Возраст.
- Сексуальная активность.
- Физическая подготовленность.
- Генетика.
- Качество производимого препарата.
- Скорость опорожнения желудка.
- Желудочно-кишечная мальабсорбция.
- Состояние функциональности системы (почки, печень).
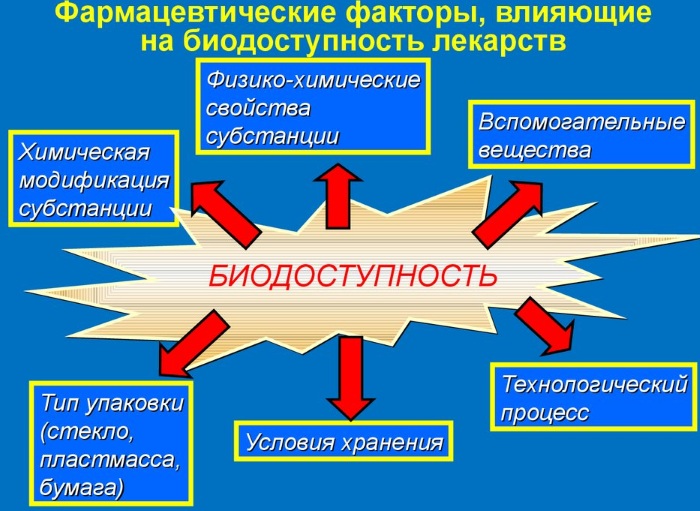
Другими факторами, влияющими на биодоступность, являются взаимодействия с пищевыми продуктами, другими лекарственными средствами, а также с лекарственными травами и растительными средствами.
Что такое биоэквивалентность?
Биоэквивалентный лекарственный продукт означает, что биодоступность и клинические результаты тестируемого продукта и лекарственного средства, указанного в перечне как оригинала, существенно не отличаются. Фармакокинетические исследования проводятся для определения общих характеристик коммерчески доступного бренда и версии дженерика.
При этом биоэквивалентность или фармацевтическая эквивалентность должны присутствовать, показывая, что два препарата высвобождают активный ингредиент в кровоток в одинаковом количестве, с одинаковой скоростью и имеют одинаковое качество.
Биоэквивалентность не требует полного процесса клинических испытаний, через который должна была пройти версия оригинального бренда. Вместо этого препараты должны быть только биоэквивалентными. Биоэквивалентность позволяет назначать более дешевые дженерики.
Биоэквивалентность не может быть заявлена на основании только испытаний invitro или только исследований на животных. Биологическая эквивалентность человеческих лекарств должна быть определена у людей с помощью установленных показателей биодоступности. Точно так же препараты для животных должны быть проверены на биоэквивалентность у животных, для которых предназначен препарат.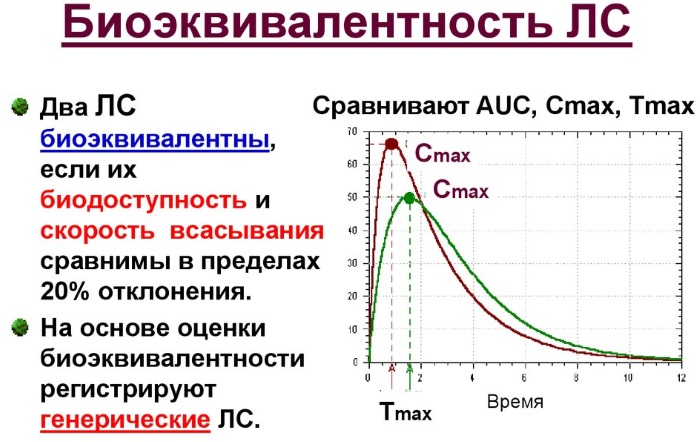
После того как биоэквивалентность была установлена путем тестирования биодоступности статистически значимым образом, последующие партии одного и того же продукта считаются биоэквивалентными на основе мер invitro, таких как растворение лекарственного средства.
Утверждение о повышенной биологической эквивалентности не имеет смысла. Продукт не может быть более биоэквивалентным или менее биоэквивалентным.
Как определяется показатель?
Биодоступность лекарственных средств – это количество молекул действующего вещества, дошедших до назначенного места. Определяется она путем вычисления фармакокинетической кривой.
Абсолютная биодоступность:
[ППК] по* ДОЗА в/в
F= ───────────────
[ППК] вв* ДОЗА п/о:
- ППК – кривая «концентрация-время».
- ВВ – внутривенное введение препарата.
- ПО – пероральное введение препарата.
Площадь под кривой представляет собой область концентрации лекарства в плазме крови в зависимости от времени. Эта площадь показывает общее воздействие активного вещества на организм. С её помощью оценивается и сравнивается биодоступность препарата. Символ Тмакс. обозначает время самой высокой концентрации в крови, а C макс. означает максимальную концентрацию.
За меру биодоступности принимается процентное соотношение количества всосавшегося препарата исследуемой формы к количеству абсорбированного средства в той же дозе эталонной формы. Стандартом служит в/в инъекция или раствор. Биодоступность лекарственных средств устанавливается различными путями.
Это 3 основных метода:
- in vitro (в пробирке) с помощью приборов;
- in vivo (внутри живого организма) на животных;
- in vivo у здоровых людей-добровольцев.
Доклинические исследования препарата на людях охватывают несколько фаз:
| Число участников | Продолжительность | Цель |
Фаза I |
||
| От 12 до 24 человек | Несколько месяцев | Выявление максимально безопасной дозы препарата. |
|
Фаза II |
||
| От нескольких десятков до нескольких сотен человек | От 1–6 месяцев до 2 лет | Выявление побочных эффектов и проверка эффективности воздействия. |
|
Фаза III |
||
| От 1 сотни до нескольких тысяч | От 1 года до нескольких лет | Подтверждение эффективности, выявление побочных действий препарата, которые не были выявлены в предыдущие фазы. |
|
Фаза IV |
||
| Несколько тысяч человек | В зависимости от препарата продолжительность опыта может быть разная. | Дополнительные вопросы проверки эффективности и безопасности. |
Испытания, проводимые в 4-й фазе, необязательны для вывода препарата на рынок. Этот период часто совпадает с активным использованием его в повседневной жизни.
Как осуществляется подготовка добровольцев?
Перед началом продажи препарата изучается биоэквивалентность и биодоступность лекарства.
С этой целью проводится следующая процедура:
- Производитель подает заявку в Государственный фармакологический комитет о желании выпустить лекарство в реализацию. Агентство, в свою очередь, выдает разрешение на проведение исследований биоэквивалентности с использованием двух образцов: существующего и нового.
- Исследование проводится на здоровых добровольцах или имеющих определенное заболевание в одинаковой дозировке.
- Данная процедура проводится в специальных медицинских учреждениях или лабораториях с привлечением сторонних специалистов.
Отбор кандидатов для исследования должен соответствовать следующим параметрам:
- Возраст добровольцев должен быть совершеннолетним и не должен превышать 60 лет.
- Вес каждого человека не должен быть меньше или превышать 20% от идеального веса, соответственно полу, возрасту и росту.
- Не разрешается проводить исследования на людях, страдающих сердечно-сосудистыми или хроническими заболеваниями. Исключение составляет группа лиц, для которых будет рекомендовано использование этого препарата.
После того как волонтёр подписал договор и соглашение о конфиденциальности, исследователи проводят полный медицинский осмотр добровольцев.
Это включает в себя:
- Общий медицинский осмотр.
- Анализ крови и мочи.
- Биохимия крови.
- Анализ крови на ВИЧ, сифилис и гепатит.
- Определение беременности у женщин.
Кто допускается к исследованиям?
К доклиническим исследованиям могут привлекаться:
- научно-исследовательские организации;
- высшие учебные заведения, имеющие специальную материально-техническую базу и квалифицированных специалистов.
Испытательный центр должен пройти обязательную аккредитацию, подтверждающую научный уровень специалистов.
Составление отчета о проведенной работе
По завершении всех исследований выдается документ, в котором должны быть отражены следующие пункты:
- Общий план фармакологических исследований, который одобрен Фармакологическим государственным комитетом.
- Все данные о волонтерах. Должны быть указаны демографические, антропометрические и клинические данные.
- Названия компаний-производителей, а также продолжительность лечебного воздействия препарата.
- Вариант препарата и эффективная доза.
- Метод отбора проб биологического материала и его предварительная обработка.
- Последовательность представления аналитики с введением метрологических показателей и демонстрационная хроматограмма.
- Полное изложение всего курса фармакокинетических исследований и оценки биологической эквивалентности.
- Результаты определения количества препарата в биологических образцах.
- Медицинские записи волонтеров и индивидуальные профили.
- Результаты дисперсионного исследования значений фармакокинетики, использованные для оценки биологической эквивалентности.
Индивидуальные вариации различий в метаболизме
На биодоступность препаратов оказывают влияние индивидуальные различия человека, которые также учитываются при разработке новых продуктов.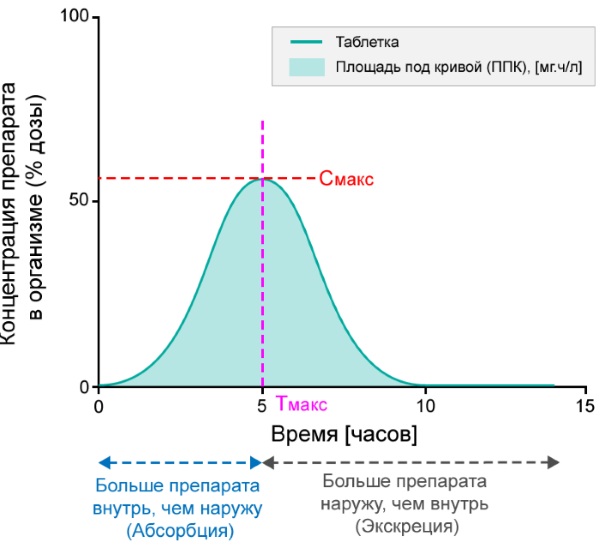
К ним относятся:
- Фенотипическая изменчивость. Под этим термином подразумевается изменения в организме под влиянием окружающей среды.
- Кишечно-печеночная циркуляция желчных кислот.
- Возраст. Было доказано, что биодоступность препаратов замедляется у новорожденных и пациентов старших возрастных групп.
- Половые различия.
- Нарушенные функции органов, например, заболевания печени, слабая деятельность почек.
Способы повышения биодоступности
Для улучшения доступности лекарственных веществ, применяются следующие методы:
- Физико-химические: ионизация лекарственных веществ, введение растворителей, приготовление коллоидных растворов.
- Химические: модификация структуры лекарственного вещества.
- Физические: разработка твёрдых дисперсных веществ.
- Технологические: введение наночастиц, дезинтегрантов (веществ, добавляемых в твердые формы для лучшего их расщепления), эмульгирование.
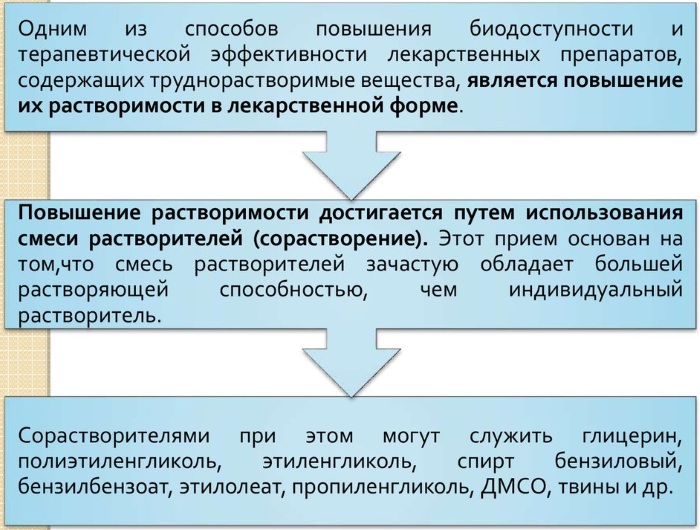
Все эти способы и приемы улучшают растворимость, проницаемость препаратов через естественные барьеры на различных этапах взаимодействия лекарств в организме.
Биодоступность препаратов при различных путях введения
Биодоступность лекарственных средств – это главный показатель, который характеризует количество потерь вещества в организме. Следовательно, эффективность препарата во многом зависит от способа введения, каждый из которых имеет свои преимущества и недостатки.
Пути введения препаратов и их биодоступность:
- Пероральный. Это относительно медленный способ проникновения действующего вещества. После проглатывания препарат растворяется в желудке, затем всасывается в кровоток через слизистую оболочку желудка, а затем и тонкую кишку.
- Сублингвальный (подъязычный) приём. Лекарство начинает в этом случае взаимодействовать со слюной, что существенно замедляет всасывание.
- Ректальное. Ректальное использование включает введение лекарственного средства в прямую кишку, где оно может растворяться и всасываться в кровоток через слизистую оболочку прямой кишки. Поглощение обычно относительно медленное.
- Парентерально — внутривенно, внутримышечно, подкожно. Это самый быстрый способ достижения лекарственного эффекта.
Препараты, вводимые внутривенно, имеют биодоступность 100%, в то время как другие имеют меньший показатель, потому что:
- весь препарат не может быть адсорбирован;
- метаболизм активного вещества может произойти до достижения места действия.

Препарат, вводимый в организм, подвергается химическим и метаболическим изменениям, которые снижают биодоступность вещества на его конечном месте действия.
Например, некоторые лекарственные средства могут быть неэффективными при пероральном приёме, но могут быть результативными при введении путем инъекции. Выбор правильного пути поступления лекарства в организм позволяет получить максимальный терапевтический эффект от препарата.
Видео о биодоступности
Фармакология и фармакинетика простыми словами:
