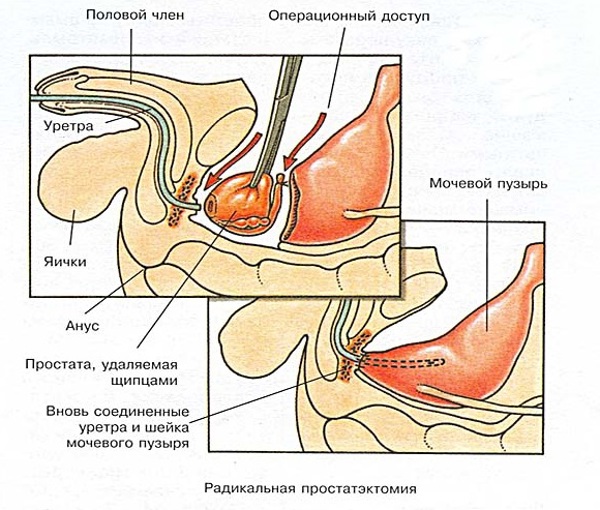
При проведении радикальной простатэктомии иссечению подвергают тело предстательной железы с прилегающими тканями и пораженными злокачественным процессом лимфатическими сплетениями.
После операции иногда наблюдается повышенное содержание в крови ПСА – простатического неспецифического антигена.
Общая характеристика
Хирургическая процедура предусматривает полную или частичную ампутация предстательной железы с паренхиматозной капсулой, сегментом мочевыделительного канала, семенными пузырьками.
Применяют классический скальпельный метод оперативного вмешательства, лазерное или эндоскопическое оборудование. ПСА после радикальной простатэктомии повышается из-за сохранения некоторого количество малигнизированных клеток, продолжающих секретировать специфический белок.
Отклонение лабораторного показателя от референсного значения может быть связано с эффектом локального, биохимического или системного рецидива. Механическое повреждение простаты скальпелем способно активизировать синтез биохимического маркера.
К повышению концентрации белкового вещества в сыворотке крови приводит продолжающееся развитие доброкачественной гиперплазии или онкологического процесса после хирургической манипуляции.
Другая распространенная причина заключается в занесенной инфекции из-за нарушения правил антисептики в ходе подготовки и при проведении операции. Радикальная резекция связана со сильным физиологическим стрессом.
Такое состояние угнетает иммунитет и создает благоприятные условия для проникновения в структуру органа экзогогенных возбудителей или активизации эндогенной микрофлоры.
Хирургическое повреждение предстательной железы провоцирует локальную ишемию или сосудистый инфаркт. Травмирующие органические ткани воздействия вызывают увеличение концентрации специфического биохимического маркера.
Норма
Референсным значением после хирургического вмешательства считается показатель 0,2 нг/мл. Незначительные колебания возникают под влиянием возрастных и соматических факторов.
К первым относятся:
- эректильная функция;
- репродуктивная способность;
- интенсивность секреции половых гормонов;
- степень физического развития пациента;
- уровень либидо.

Соматическими факторами влияния на содержание ПСА после выполнения хирургического вмешательства считаются воспалительные процессы, латентные инфекционные поражения и паразитарные инвазии.
В таблице представлены референсные значения после иссечения предстательной железы для пациентов разных категорий.
| Возраст, лет | Нормативный показатель, нг/мл |
| До 40 | Не более 2,5 |
| 41-50 | 2,6-3,2 |
| 51-60 | 3,3-3,7 |
| Старше 60 | До 4,5 |
Динамический лабораторный мониторинг используют для оценки результативности проведенного хирургического вмешательства, выявления развивающегося рецидива, целесообразности применения лучевой, медикаментозной или химиотерапии.
Индивидуальное значение концентрации специфического белкового антигена для каждого пациента устанавливают индвидуально с учетом указанных выше возрастных, физиологических и патологических факторов.
Причины отклонений
Увеличение концентрации биохимического маркера часто связано с физиологическими изменениями, инвазивными диагностическими обследованиями или физиотерапевтическими процедурами, проведенными непосредственно перед сдачей анализа.
К таким причинам отклонений относят:
- интенсивное массирующее воздействие на предстательную железу, улучшающее трофические процессы, насыщающее клетки питательными веществами, повышающее их секреторную активность;
- биопсический забор контрольного образца простатических тканей, обеспечивающий контроль эффективности частичного удаления органа, но вызывающий повышение уровня антигена на срок до 6-8 недель;
- эякуляция на протяжении 24 ч. перед лабораторным тестом;
- прием цитостатических или гормональных препаратов.
ПСА после радикальной простатэктомии повышается из-за представленных факторов кратковременно и ситуативно.
Причины более устойчивого нарушения установленного норматива концентрации белкового маркера:
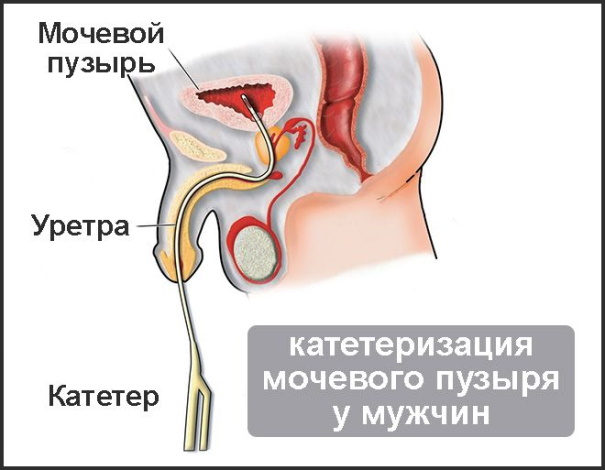
- Острое нарушение мочеиспускательной функции. Патологическое состояние связано с повреждение в ходе хирургического вмешательства выделительного канала.
Дисфункция возникает при катетеризации мочевого пузыря. Ишурия приводит к избыточной компенсаторной активности простатических клеток.
- Рецидив онкологического процесса. Повторная малигнизация или сохранение некоторого количества злокачественно измененных клеток считается частой причиной отклонения лабораторного показателя от установленного референсного значения.
Подобный эффект возникает при метастазировании отдаленных от первоначального очага анатомических структур.
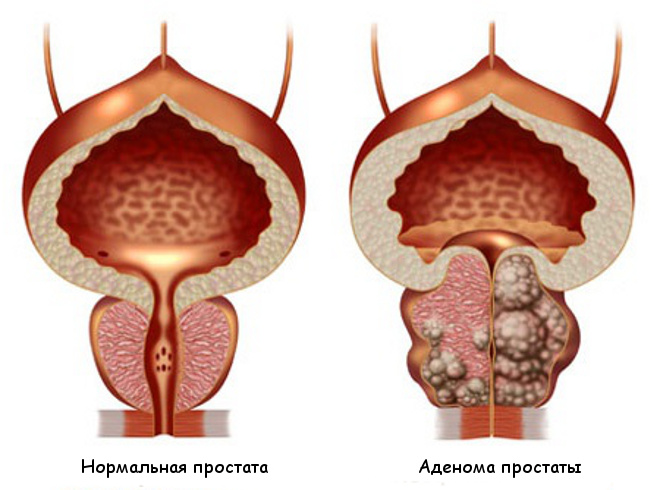
- Аденома. Патологический процесс представляет собой разрастание железистых тканей за пределы естественного анатомического ложа. Аденома часто сочетается с острой ишурией.
В такой клинической ситуации повышение концентрации простатического антигена существенное. Причина нагнетания маркера считается комплексной.
- Инфекционные поражения простаты. Развивающийся воспалительный процесс с абсцедированием повышает секреторную активность клеток органа.
Распространенными возбудителями считаются золотистые стафило- и энтерококки, протеи. Повышение ПСА вызывают мочеполовые инфекции и желудочно-кишечная флора, проникающая в ткани органа гематологическим или лимфатическим путем.
Самое высокое отклонение лабораторного показателя от референсного норматива характерно для рецидива злокачественного новообразования после иссечения классическим скальпельным способом.
Симптоматические проявления
Клинические признаки зависят от размера неоплазии, зоны локализации, анатомо-физиологических характеристик вовлеченных тканей. В начальной стадии часто единственным симптомом рецидива онкологического процесса служит отклонение лабораторного показателя в сторону повышения.
С увеличением диаметра злокачественного очага развиваются признаки, обусловленные механической компрессией мочевыделительного канала, гемодинамическими нарушениями, расстройствами лимфатического оттока в ложе ампутированного органа.

Типичные симптомы:
- частые позывы к мочеиспусканию;
- прерывистая деуринация с болезненными ощущениями и спастическим компонентом;
- гематурия – кровянистые включения в выделяемой жидкости с существенным объемом эритроцитарных тел;
- никтурия – спонтанные ночные позывы к мочеиспусканию;
- жжение после физиологического акта.
Наблюдаются репродуктивные нарушения вплоть до полной импотенции. Возникают тянущие боли в паховой зоне.

При повышенном уровне специфического белкового маркера после хирургического вмешательства развиваются неврологические расстройства, свидетельствующие о компрессии поясничных корешков.
Диагностические методы
Отклонение выявляют путем проведения лабораторного анализа контрольного образца венозной крови. Специфический антиген выступает информативным показателем онкологического рецидива, по достоверности уступающим только биопсии.
Процедуру выполняют методом хемилюминесцентного иммунного тестирования с применением особого способа расчета.

Общее предназначение анализа на ПСА:
- контроль эффективности проведенного хирургического лечения;
- дифференцирование онкологического рецидива с вновь появившейся доброкачественной опухолью;
- раннее обнаружение инфекционного или асептического воспаления;
- коррекция терапевтической схемы в период восстановления после резекции.
Для уточнения морфологических характеристик очага и окончательной постановки диагноза применяют аспирационную биопсию и компьютерную томографию. Послойное трехмерное сканирование тканей целевого органа обеспечивает магнитный резонанс.
Распространено сцинтиграфическое обследование – аппаратный способ визуализации с применением радиоактивных изотопов. Диагностическое оборудование создает двухмерное изображение изучаемой части тела.
Стоимость лабораторного теста на антигенный белок не превышает 600 руб. Цена аппаратных процедур колеблется в пределах 2500-4000 руб.
Методы лечения
После простатэктомии применяют преимущественно медикаментозную терапию. Альтернативой радикальному лечению служат многочисленные органосохраняющие медицинские технологии.
Для стабилизации показателя ПСА используют представленные ниже способы воздействия на злокачественно измененные клетки.
Лучевая терапия
Метод применяют при неоперабельных формах онкологического поражения предстательной железы.
Решающее значение при принятии решения о целесообразности лучевого воздействия имеют:
- возраст пациента;
- разновидность опухолевого процесса;
- зона распространения;
- сопутствующие заболевания;
- соотношение ожидаемого клинического результата с возможными негативными последствиями.
Классическим способом доступа считается дистанционно-чрескожное проникновения подаваемого излучения. Такая терапия эффективна на любой стадии заболевания.
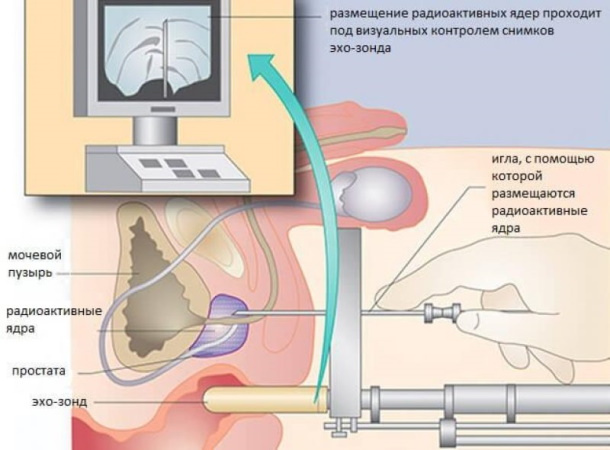
При ограниченном размещении опухолевого очага, не выходящего за пределы анатомического ложа предстательной железы, выполняют брахиотерапевтическое лечение.
Такой способ облучения предусматривает введение радиоактивного источника непосредственно в тело неоплазии. Брахиотерапия эффектна исключительно при отсутствии отдаленных метастазов. Методика снижает вероятность возникновения рецидива онкологического процесса.
Необходимую дозу излучения и поле воздействие рассчитывает специализированная компьютерная программа, гарантирующая разрушающее воздействием только на малигнизированные клетки с сохранением структуры неповрежденных тканей.
Гормональная терапия
Консервативную методику применяют в комплексе с радикальными процедурами. Гормональные препараты имеют адъювантное (профилактическое) значение и направлены на предупреждение рецидива.
Используемые медикаментозные средства купируют синтез стимулирующих рост опухолевого очага веществ.

Гормональная терапия эффективна при:
- начальной стадии онкологического процесса;
- простатической карциноме;
- невозможности хирургического вмешательства;
- противопоказания к лучевому воздействию;
- при раннем метастазировании за пределы первоначальной зоны;
- повышении белкового маркера до значения больше 25 нг/мл.
Для достижения ожидаемого клинического эффекта используют антагонисты синтезируемого гипоталамусом рилизинг-гормона, антиандрогенные вещества, эстрогеновые соединения. Такие средства подавляют функции клеток Лейдига.
Тестикулярные цитологические единицы ответственны за выработку андрогенных гормонов, развитие мочеполовой системы, репродуктивную способность. Эстрогеновые препараты дополнительно оказывают цитотоксическое воздействие на тело пораженного органа.
ПСА после радикальной простатэктомии корректируют препаратами на основе диэтилстильбэстрола – самого распространенного биохимического соединения, используемого для консервативного лечения онкологических процессов мужской мочеполовой системы.
Химиотерапия
Методика предусматривает влияние на злокачественные клетки сильнодействующими токсическими веществами, что приводит к гибели цитологических единиц.
Химиотерапевтического лечение онкологических процессов в предстательной железе подразделяют на:
- таргетное – избирательное;
- неоадъюватное, проводимое перед предстоящим хирургическим вмешательством;
- адъювантное, состоящее из 2-3 последовательных циклов разрушения пораженных клеток;
- индукционное, направленное на достижение стойкой ремиссии и предупреждение рецидива;
- гипертермическое – инновационный способ, предусматривающий подачу в очаг разогретого до 42-43°С препарата;
- щадящее – базируется на введении специального раствора, приостанавливающего рост новообразования без полной его ликвидации;
- платиновое, эффективное при онкологическом процессе крови и лимфатической жидкости;
- высокодозное, требующее применения ударных объемов противораковых медикаментов;
- паллиативное, назначаемое на терминальной стадии неоперабельной опухоли.
Методика блокирует процесс деления патологически измененных клеток. Цитотоксическое лечение назначают исключительно пациентам, способным перенести подобное воздействие.
Химиотерапия отличается многочисленными тяжелыми побочными эффектами, и негативными последствиями для внутренних органов.
Лимфаденэктомия
Резекцию выполняют при поражении соответствующих сплетений, что характерно для II стадии онкологического процесса. Для достижения выраженного клинического результата операцию производят одновременно с иссечением паренхиматозной оболочки органа и железистых тканей.
Удаление лимфатических узлов позволяет воспрепятствовать распространению неоплазии на другие органы.
В соответствии с объемом и функциональными характеристиками иссекаемых тканей операцию подразделяют на регионарную, селективную, обширную. Выбор способа вмешательства зависит от типа и стадии опухолевого процесса.
ПСА после радикальной простатэктомии с попутной лимфодиссекцией в большинстве случаев быстро возвращается к нормативному показателю. Совмещенную операцию выполняют при любой форме опухолевой патологии.
Необходимость хирургического вмешательства определяют прогностические параметры – агрессивность неоплазии.
При несклонных к метастазированию и стремительному разрастанию патологических процессах стараются избегать ампутационного мероприятия, отдавая предпочтение органосохраняющим техникам лечения.
Простатэктомия
Ключевая задача хирургической процедуры заключается в полном излечении пациента с восстановлением базовых функций предстательной железы.
Операцию по частичному или полному удалению органа характеризуют:
- малая вероятность рецидива онкологического процесса;
- быстрая стабилизация показателя ПСА;
- минимальное травмирование прилегающих тканей;
- улучшение качества и продолжительности жизни.
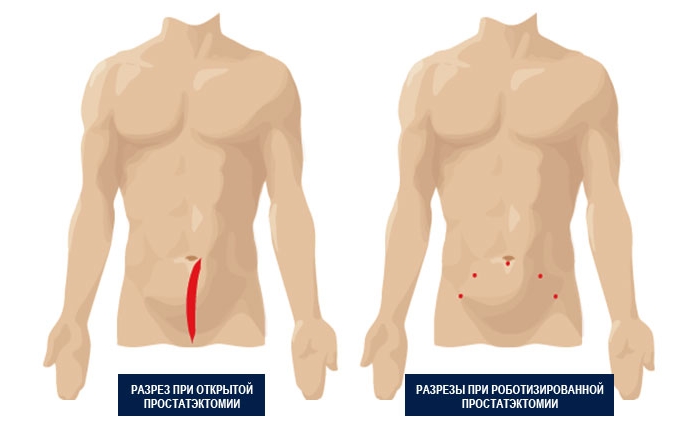
Радикальное хирургическое вмешательство в зависимости от клинической ситуации проводят открытым или закрытым способом с промежностным доступом. Широко практикуют лапароскопическую процедуру, считающуюся малоинвазивным вмешательством.
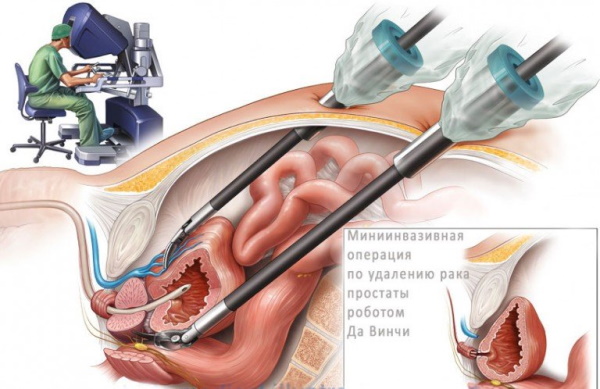
Такая методика обеспечивает быстрое восстановление и сокращает период физиологической реабилитации. Инновационную технику простатэктомии представляет собой операция с использованием специального робота-манипулятора, позволяющего достичь абсолютной точности действий.
Хирургическое вмешательство
Радикальную резекцию назначают при неэффективности консервативного лечения онкологической или доброкачественной опухоли предстательной железы, вызывающей повышение уровня специфического антигенного белка.
Поводами к проведению хирургического вмешательства считаются:
- агрессивность неоплазии;
- повышенный риск отдаленного метастазирования;
- тяжелые нарушения мочевыделительной функции, не устранимые консервативными методами;
- сдавливание нервных корешков в нижнем сегменте позвоночного столба;
- сочетание аденомы с другим опухолевым процессом.
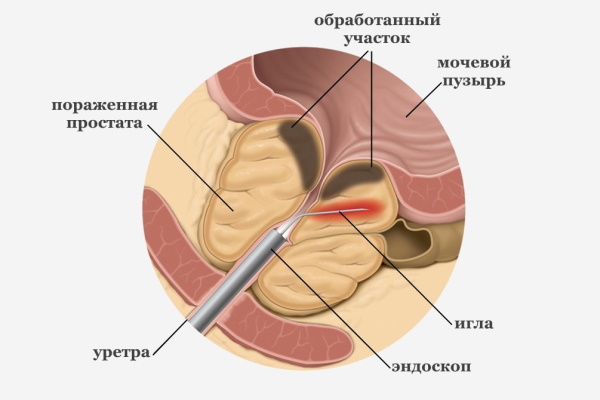
Кроме приведенных выше хирургических способов, применяют лазерное воздействие на пораженный орган. Преимущество технологии заключается в бескровности. Лазерный генератор обеспечивает испарение злокачественного очага с попутной коагуляцией сосудистых отверстий.
Возможные последствия и осложнения
Несмотря на большое количество негативных эффектов, радикальное лечение повышенного содержания в крови белкового антигена приводит к смерти пациента только в 0,3% случаев. Все они касаются терминальной стадии онкологического заболевания.
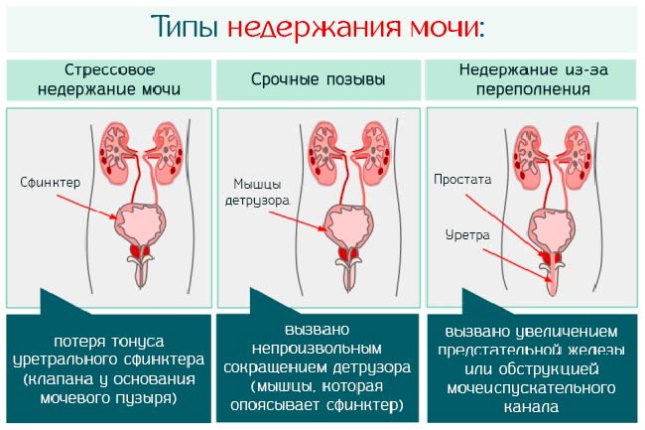
Распространенные риски, отдаленные осложнения и последствия:
- импотенция;
- недержание мочи;
- нарушения эрекции;
- оргазмическая дисфункция;
- эмболия легочных артерий;
- травматизация ректального сфинктера;
- сужение уретрального канала.
Кратковременные негативные эффекты связаны непосредственно с хирургическим вмешательством и применением системного наркоза, создающего высокую нагрузку на кардиальный аппарат. После операции возможны головокружение, тошнота, вестибулярные нарушения.
Избежать рецидива опухолевого процесса позволяет периодический контроль показателя ПСА.
Лечение онкологической или доброкачественной неоплазии методами радикальной простатэктомии требует в период восстановления и после завершения реабилитации регулярных обследований урологом.
Видео о ПСА
ПСА после радикальной простатэктомии:
