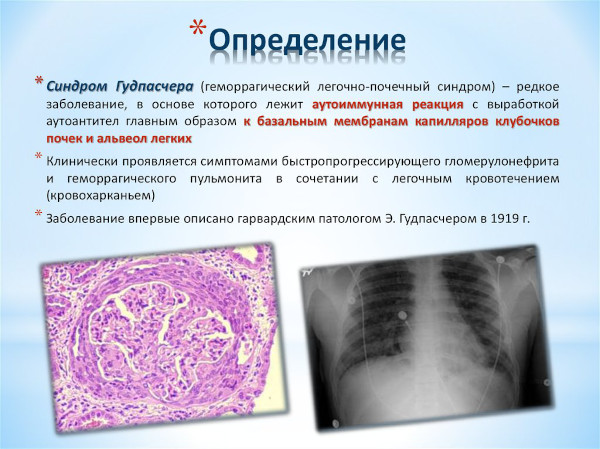
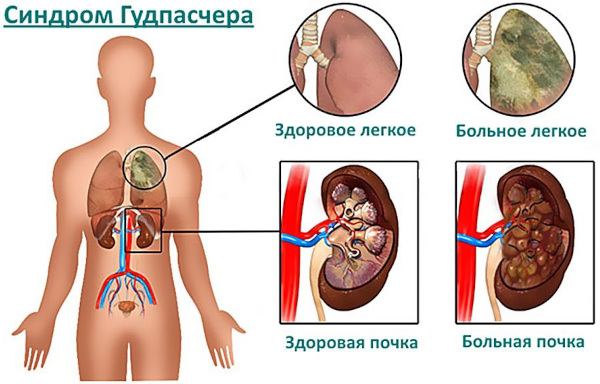
Названный именем американского патофизиолога Эрнеста Гудпасчера аутоиммунный синдром обусловлен образованием специфических антител к базальным мембранным оболочкам клеток механизма клубочной фильтрации почек и легочных альвеол. Нарушение характеризуется рецидивирующим, злокачественным протеканием.
Причины
Этиологические факторы достоверно не выяснены.
На основе клинических наблюдений установлена связь заболевания с:
- вирусными инфекциями – гриппом, возбудителем гепатита, штаммом Эпштейна-Барра;
- неконтролируемых или продолжительным приемом некоторых лекарственных средств – Карбимазола, Пеницилламина;
- регулярным вдыханием промышленных испарений – органических растворителей, лакокрасочных смесей, топливных составов;
- систематическим переохлаждением тела.
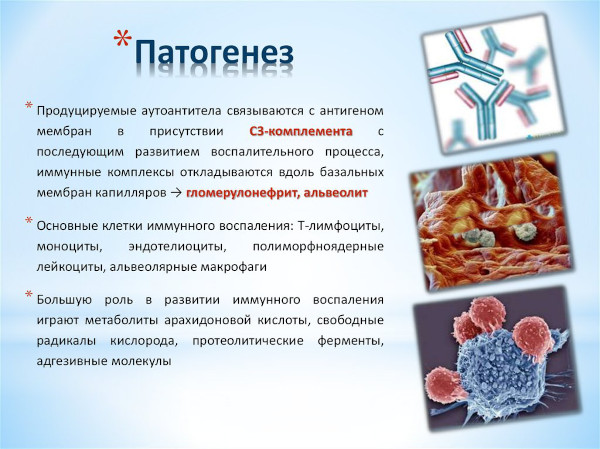
Синдром Гудпасчера предположительно развивается из-за нарушения иммунной толерантности под влиянием указанных факторов и раздражителей. Существенна роль в возникновении заболевания принадлежит генетической предрасположенности.
Причисляемая к категории системных васкулитов геморрагическая легочно-почечная патология нередко обнаруживается у носителей генных аллелей (последовательностей) HLA-DRwl5, HLA-DRB1. Известны случаи наследственной передачи аутоиммунного синдрома.
Среди факторов риска выделяют:
- остро протекающие инфекционные заболевания вирусного генеза;
- курение;
- химические и лекарственные интоксикации;
- онкологические процессы;
- иммунный дефицит;
- неумеренное употребление алкогольных напитков;
- наркотическую зависимость.
Заболевание может возникать в качестве осложнения хронической нефропатии, красной волчанки, криоглобулинемии – стабильного содержания в сывороточной фракции крови преципитатных белковых молекул, обладающих повышенной чувствительностью к холоду, осаживающихся при температуре ниже 37°С.
Патогенез
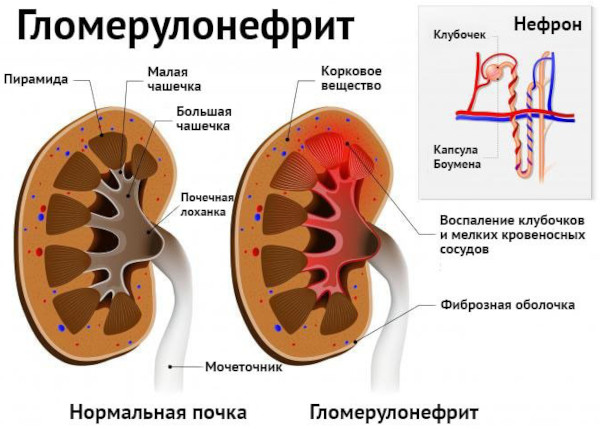
Основой механизма развития легочно-почечного васкулита считается выработка специфических антител к собственным тканям целевых органов. Образующееся при расстройстве иммунной системы глобулины причисляются к классу lgG. Такие молекулы связывают защитные белки базальных мембран, что приводит к развитию воспалительного процесса.
В результате цепных реакций развивается фокально-сегментарный некротический гломерулонефрит с:
- разрушением сосудистых петель;
- массивной инфильтрацией почек и легких лейкоцитарными телами;
- множественными разрывами базальной мембраны;
- диффузным отмиранием тканей;
- геморрагическим альвеолитом.
Патоморфологические изменения подразделяют на легочные и почечные. Последние характеризуются дисциркуляторными расстройствами кровообращения, деструктивно-пролиферативными процессами, нарушением солевого обмена.
Почечный патогенез включает признаки экстракапиллярного гломерулонефрита и гиалиноза – разновидности белковой внеклеточной дистрофии с образованием в тканях однородных полупрозрачных очагов, структурно схожих с гиалиновыми хрящами.
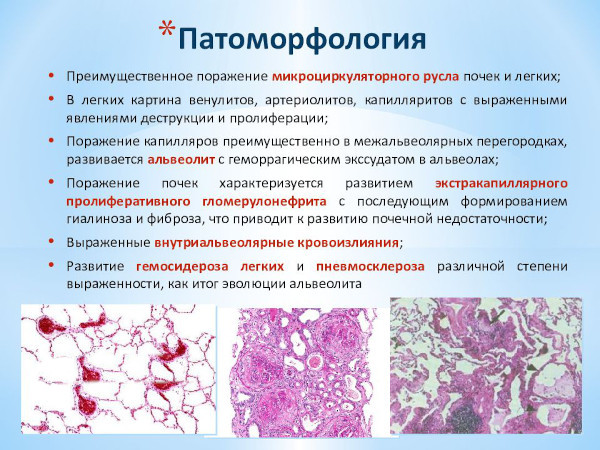
Развивается неспецифический фиброзно-склеротический процесс, обусловленный сдавливанием сосудистых русел с мочеточниками. Характерный для патогенеза аутоиммунного нарушения экстракапиллярный гломерулонефрит быстро прогрессирует и угнетает функции органа.
Симптоматика и клиническая картина
Начальные признаки аутоиммунного нарушения имеют общесоматические проявления.
Типичными неспецифическими симптомами считаются:
- аномально быстрая утомляемость;
- постоянный дискомфорт в брюшном пространстве и правом подреберье;
- дыхательные затруднения;
- бледный оттенок кожной поверхности лица, шеи, рук;
- болезненные ощущения в суставных капсулах нижних конечностей;
- частые эпизоды недомогания;
- периодическая лихорадка;
- стремительную потерю массы тела.
По мере прогрессирования заболевания клиническую картину дополняют спонтанные приступы головокружения, субфебрильная гипертермия, цианоз эпидермальных покровов. В острой стадии к симптомам присоединяются легочные кровотечения, почечная гипертензия.
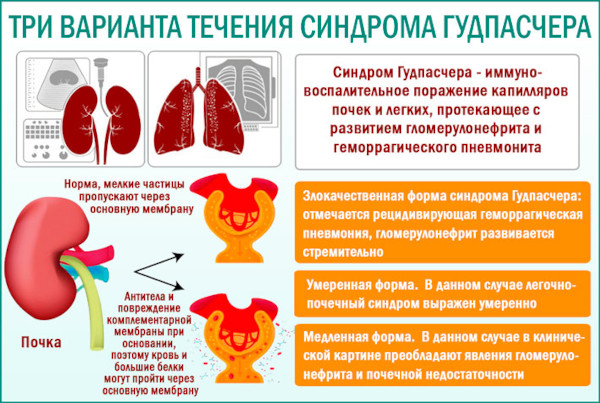
Синдром Гудпасчера характеризует отечность лица, нижних и верхних конечностей из-за нарастающей функциональной недостаточности нефротического механизма фильтрации и выведения жидкостей. Выделяют представленные в таблице клинические формы протекания аутоиммунного заболевания.
| Разновидность | Патофизиологические характеристики |
| Медленно развивающаяся | Гематурический или гипертонический гломерулонефрит сочетается с постепенно прогрессирующей функциональной недостаточностью почек. |
| Умеренное протекание | Такой форме заболевания свойственны клинические признаки гемолитико-уремического синдрома, проявляющегося сниженной концентрацией эритроцитов и тромбоцитов. Симптоматика сочетает диарею с лихорадкой и рвотой. |
| Злокачественная | Самая агрессивная форма аутоиммунной патологии содержит компоненты быстро прогрессирующего гломерулонефрита с выраженной рецидивирующей пневмонией геморрагического типа. Чревата смертью пациента вследствие профузного легочного кровоизлияния или физиологической асфиксии. |
Для клинической картины любой формы заболевания характерно нарушение водно-электролитного баланса. Легочно-почечный патологический процесс нередко осложняет сердечная астма. Аутоиммунный синдром в частых случаях сопровождают артралгическая и миалгическая симптоматика, перикардит.
Методы диагностики
Требуется комплексное обследование пациента. Диагностика нацелена на дифференцирование почечно-легочного синдрома с другими аутоиммунными заболеваниями.
Для корректного подбора терапевтических средств и мероприятий заболевание необходимо отличить от:
- Рака легких. Онкологическая патология происходит из паренхимы органа и бронхиальных тканей, имеет схожие клинические проявления.
- Туберкулеза. Инфекционное заболевание отличается похожей симптоматикой, но требует другого лечения.
- Бронхоэктазы. Характеризуется необратимыми изменениями в легких, гнойно-некротическим процессом, функциональной неполноценностью органа.
- Гемосидерозом. Заболевание со схожей клинической симптоматикой провоцирует массовое депонирование в почечных и легочных тканях железосодержащего пигмента под названием гемосидерин.
- Синдромом Черджа-Стросса. Заболевание манифестируется воспалительно-аллергическим поражением легочно-почечных сосудов мелкого и среднего калибра.
Диагностический поиск сочетает инструментальные обследования с лабораторными тестами. Состав комплекса мероприятий варьируется в зависимости от клинических проявлений заболевания.
Сбор семейного и личного анамнеза
Мероприятие считается важным фактором терапии легочно-почечного синдрома. Учитывая генетическую специфику аутоиммунного процесса, принципиальное значение имеет сбор семейного анамнеза.
Нужные сведения профильный специалист получает во время собеседования с пациентом. Для сбора личного анамнеза используется амбулаторная карта и другая медицинская документация, освещающая подробности перенесенных заболеваний и особенности соматического статуса.
Физикальный осмотр
Выполняется параллельно с предыдущим диагностическим мероприятием. При физикальном осмотре заметны признаки поражения почечных и легочных тканей с сосудами, внешне проявляющиеся пастозностью – слабой припухлостью эпидермиса и подкожной клетчатки.
Синдром иммунного воспаления сопряжен с сухими или влажными хрипами. Такой симптом при заболевании Гудпасчера обнаруживают в процессе проведения стетоскопии. Физикальное обследование предусматривает выполнение тонометрии – измерение артериального давления.
При аутоиммунном нарушении показатель всегда повышен, сердечные ритмы – приглушены. Визуально заметен отек нижних век. Физикальный осмотр предоставляет предварительную диагностическую информацию и служит основанием для проведения углубленных аппаратно-лабораторных обследований пациента.
Инструментальные исследования
Ведущими методами считаются ультразвуковое сканирование и рентгенография.
Вспомогательное значение имеют:
- Спирометрия. Обследование легочных пространств при аутоиммунной патологии фиксирует морфологические изменения в интерстициальных тканях, значительное уменьшение дыхательного объема, снижение показателя вентиляционной и газообменной способностей. Стоимость процедуры – 1300 руб.
- Электрофизиологический тест. Методика основана на регистрации биоэлектрического потенциала сердечного аппарата. При почечно-легочной дисфункции на ленте самописца обнаруживаются признаки аритмии, электролитного дефицита, экстрасистолии. Цена обследования – 900 руб.
- Эхокардиография. Диагностическая значимость заключается в выявления скрытых дисфункций сердечного аппарата, ассоциированных с почечно-легочным геморрагическим синдромом. Позволяет обнаружить перикардиальный выпот, оценить функциональные резервы органа. Цена ЭхоКГ – 2500 руб.
- Компьютерная томография грудной клетки. В острой стадии аутоиммунного процесса КТ обнаруживает легочные кровотечения, области ацинарных узелковых образований с нечеткими контурами, зоны затемнения. Заболеванию свойственная выявляемая компьютерной томографией двух- или односторонняя диффузная консолидация тканей. Обследование стоит 3500 руб.

Для изучения анатомического строения легких и почек назначают обзорную рентгенографию. В зависимости от остроты аутоиммунной патологии инструментальные процедура определяет участки затемнения альвеол, сетчато-узелковые изменения в интерстициальных волокнах. Обзорная рентгенография стоит не больше 1000 руб.
Лабораторные анализы
В стандартный комплекс таких тестов обязательно входит гемограмма, предназначенная для измерения скорости оседания эритроцитарных тел. При почечно-легочном синдроме фиксируют резкое отклонения лабораторного показателя в сторону повышения.
Клинический анализ мочевой жидкости обнаруживает увеличенное количество частиц цилиндрического эпителия в контрольном образце исследуемого биологического материала. Тест выявляет свойственную заболеванию протеинурию.
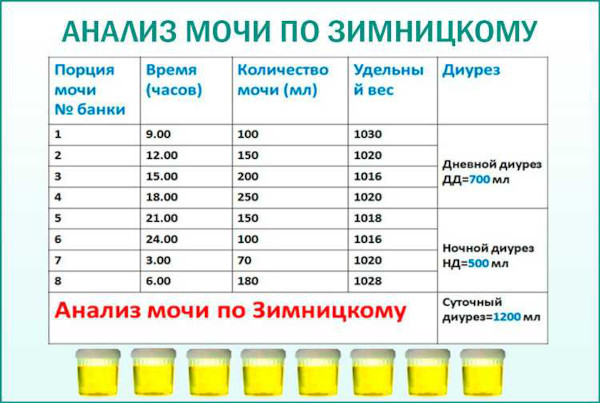
Для уточнения клинической картины выполняют специфическую пробу мочевых выделений по методике Земницкого. Аутоиммунному синдрому свойственна выявляемая лабораторным исследованием гипостенурия – относительное снижение плотности урины до 1005 г/мл и меньше.
Для определения концентрации железа, мочевины, креатинина предназначается биохимический тест крови. Дополнительно изучают мокроту микроскопическим способом на предмет содержания гемосидерина, сидерофагов, эритроцитарных частиц. Цена пакета лабораторной диагностики – 1200 руб.
Методы лечения
Терапевтические мероприятия нацелены на замедление прогрессирования патологии. Предпринимаемые меры позволяют достичь состояния стойкой диагностической ремиссии – как лабораторно-клинической, так и рентгенологической.
Синдром Гудпасчера требует комплексной терапии продолжительностью 6-12 месяцев. Аутоиммунное заболевание не поддается полному излечению. Ниже представлены используемые средства и методы терапии.
Лекарственные препараты
В стадии обострения применяют комбинированное лечение ударными дозами кортикостероидов. Такие препараты назначают кратким курсом. Методику называют комбинированной пульс-терапией.
В рамках интенсивного лекарственного лечения используют сочетание Метилпреднизолона с Циклофосфаном – противоопухолевым препаратом, оказывающим выраженное цитостатическое воздействие.
Медикаментозную смесь вводят инфузионным способом в течении 30-60 мин. на протяжении 3-5 дней. Цитостатические свойства Циклофосфана дополняются иммуносупрессивным воздействием Метилпреднизолона.
Для поддерживающего лечения назначают Азатиоприн в таблетках – антиметаболит, блокирующий клеточную деление с тканевой пролиферацией. Такое терапевтическое воздействие замедляет фиброзную трансформацию структурных элементов пораженных органов.
Плазмаферез
Цель процедуры заключается в деактивации циркулирующих в кровеносных руслах комплексных соединений повышенной иммунной агрессивности.
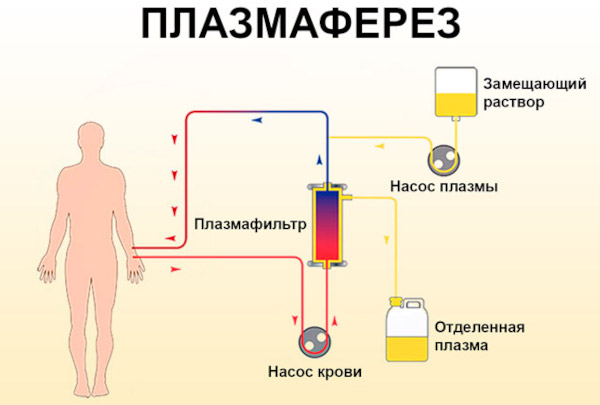
Центрифугирование плазмы дополнительно позволяет достичь элиминации:
- специфических антител в несвязанном состоянии;
- антигенов, провоцирующих резкий иммунный ответ и выступающих в качестве раздражителей для биологического защитного механизма.
- экзогенных токсинов – отравляющих веществ, служащих сопутствующим или вспомогательным триггером аутоиммунного процесса;
- гормонов, вырабатываемых различными железами внутренней секреции, усиливающих остроту протекания почечно-легочного геморрагического синдрома;
- липидов – крупных молекул, сгущающих кровь, отягощающих клиническую картину заболевания;
- бактериальных белков – высокомолекулярных азотистых соединений класса полимерных кислот, чужеродных для тканей и жидкостей человеческого организма.
Существенным недостатком дискретного плазмафереза считается неизбирательное действие с необходимостью последующего применения заместительной терапии с переливанием эритроцитарной массы, использованием железосодержащих растворов.
Внутривенное введение Метилпреднизолона и Циклофосфамида
Классическая схема предусматривает инфузионное введение сверхвысоких доз кортикостероида – по 1000 мг в сутки. С 1-го или 2-го дня интенсивного курса к Метилпреднизолону добавляют Циклофосфамид.
Синдром Гудпасчера предусматривает введение химиотерапевтического препарата из расчета 10-15 мг/кг массы тела. Порошковые лекарства смешивают с раствором хлорида натрия в одном флаконе и подают в магистральную вену на локтевом сгибе одновременно через медицинскую капельную систему.
Переливание эритроцитарной массы
Трансфузия концентрированного биологического материала предназначена для восстановления физиологически оптимального содержания соответствующих кровяных клеток после проведения плазмафереза.
Процедура улучшает показатели сатурации для предотвращения кислородного голодания тканей и клеток, развития сопутствующего анемического состояния. Эритроцитарную массу для переливания используют в виде очищенной взвеси.
Сеансы гемодиализа
Методика представляет собой процедуру внепочечной фильтрации гематологической жидкости для удаления токсических веществ, солевых соединений, продуктов метаболического распада.
Сеансы гемодиализа эффективны на терминальной стадии аутоиммунной патологии и применяются с разной периодичностью в зависимости от остроты протекания заболевания, выраженности функциональной недостаточности нефротического механизма.
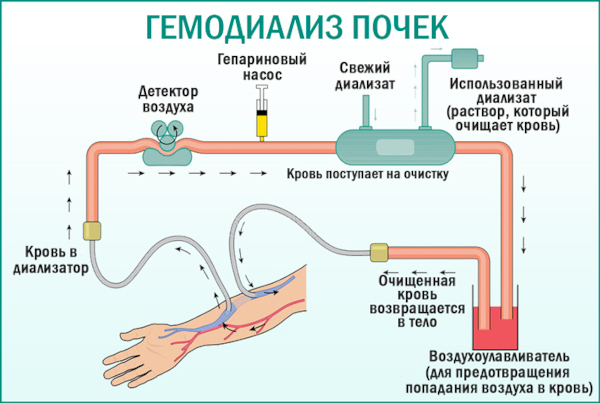
Процедура направлена на восстановления электролитного равновесия крови, выведение диализируемых токсических веществ, снижения побочных воздействий кортикостероидных гормонов и химиотерапевтических препаратов.
Прогноз
Заболевание неостановимо прогрессирует. Даже нефроэктомия с последующей пересадкой удаленного органа, не исключает возникновения в нормально прижившемся трансплантате некротической формы гломерулонефрита. Прогноз патологии не обнадеживающий.
Высока вероятность скоропостижной смерти пациента из-за:
- открывшегося профузного легочного кровоизлияния;
- острого сердечного криза;
- некротического разложения почек или легких;
- физиологической асфиксии.
Злокачественное протекание аутоиммунной патологии приводит к гибели на протяжении 2-3 недель. При доброкачественном почечно-легочном синдроме и постоянной поддерживающей терапии продолжительность жизни исчисляется несколькими месяцами или годами.
Смерть в большинстве клинических ситуаций наступает, согласно статистике, на протяжении 3-5 лет. Известны единичные случаи самопроизвольной ремиссии с существенным улучшением состояния пациента. Научное объяснение такого эффекта не найдено.
Возможные последствия и осложнения
Патологический процесс способен вызвать полиорганную недостаточность. Исход заболевания всегда смертелен. Гибель позволяет отсрочить лишь постоянная поддерживающая терапия.
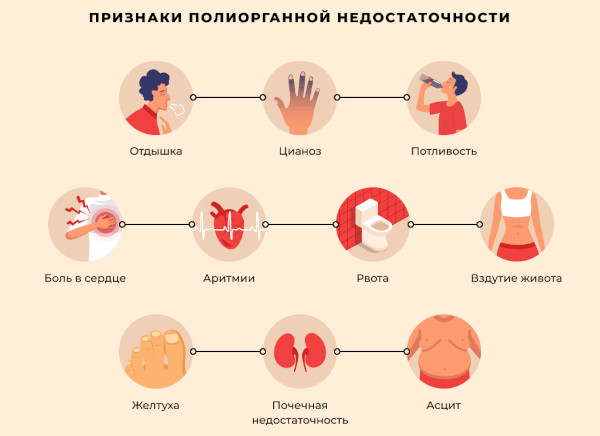
Грозными осложнениями считаются нарушения системного кровообращения, некротический распад легочных и почечных тканей, острая интоксикация организма из-за угнетения фильтрующей функции нефротического механизма.
Аутоиммунный синдром – редко возникающая, но опасная для жизни патология, характеризуемая разрушением собственными антителами базальных мембран почечных клеток и легочных альвеол. Заболевание Гудпасчера в большинстве случаев по мере прогрессирования приобретает злокачественное протекание с летальным исходом.
Видео о синдроме Гудпасчера
Алгоритм лабораторной диагностики синдрома Гудпасчера:
