Андрогенная недостаточность с многочисленными биохимическими расстройствами и клиническими проявлениями представляет собой гипогонадотропный синдром у мужчин. Комплексное нарушение обусловлено снижением секреторной функции семенных желез. Врожденный гипогонадизмсопровождает недоразвитость половых органов.
Причины
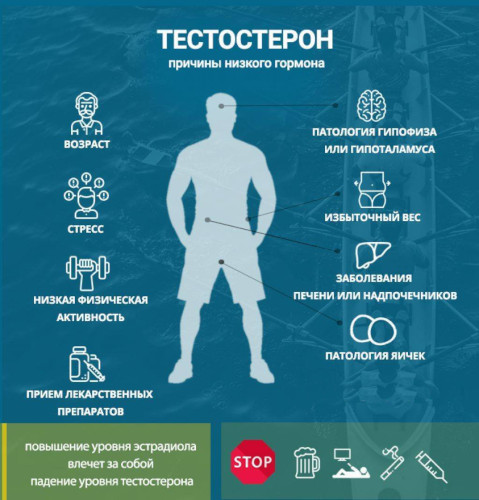
Андрогенный дефицит провоцирует уменьшенная относительно физиологической нормы выработка тестостерона или нарушение биосинтеза гормонального соединения. К такому состоянию приводят патологии тестикул, нарушения регуляторной функции гипофизарно-гипоталамусного механизма.

Гипогонадотропный гипогонадизм приобретенного происхождения развивается из-за атеросклеротического поражения сосудов семенных желез, в качестве последствия тяжело перенесенного инфекционного заболевания – ИППП, саркоидоза, паротита. Комплексное нарушение иногда сопровождает хронический туберкулез легких.
К поведенческим причинам приобретенного андрогенного дефицита причисляют:
- злоупотребление низкокачественными алкогольными напитками, содержащими большой объем токсических компонентов;
- длительный стаж курения в сочетании с индивидуальной предрасположенностью к патологиям мочеполового аппарата;
- регулярное применение наркотических и психостимулирующих веществ, провоцирующих расстройства в гипофизарно-гипоталамусной системе головного мозга;
- систематическое перегревание семенных желез при продолжительном пребывании в бане или сауне, резкой смене климатического пояса.
Комплексное расстройство тестостероновой секреции обнаруживают у пациентов в хроническими кардиальными патологиями, гипертонией и системными гемодинамическими отклонениями, связанными ухудшением тестикулярного кровообращения.
К приобретенной андрогенной недостаточности приводят механические травмы семенных желез, асептические воспаления урогенитального механизма, опухолевые процессы онкологической или доброкачественной природы.
К распространенным триггерным факторам клинического синдрома причисляют:
- ослабление механизма резистентности из-за аутоиммунных патологий, СПИДа;
- обусловленное метаболическими причинами ожирение;
- инсулинозависимую форму сахарного диабета;
- повышенную концентрацию холестерина в крови;
- уменьшенная или наоборот усиленная выработка щитовидной железой тиреоидного гормона;
- чрезмерное потребление синтетических стероидов и анаболиков, распространенное среди культуристов и представителей других силовых спортивных дисциплин.
Андрогенная недостаточность часто служит последствием оперативных вмешательств на органах мочевыделительной системы или генитального аппарата. Тестикулярные функции могут нарушать интенсивная лучевая или химиотерапия, острый дефицит витамина D, гемохроматоз – повышенная концентрация железа в крови.
Причины врожденного (первичного) синдрома тестостероновой недостаточности:
- Генетические дефекты. Подобные нарушения приводят к недоразвитости семенных желез, провоцируют дисгенезию – изменение естественного морфологического строения тестикулярных тканей.
- Вредные воздействия на организм матери во время беременности. Возникает птоз гонад новорожденного – опущенное смещение за пределы естественного анатомического ложа. Развивается аплазия тестикул – отсутствие части семенной железы.
- Синдром Кальмана. Наследственная патология обусловлена мутациями в Х-хромосоме. Называемое ольфактогенитальной дисплазией врожденное заболевание негативно влияет на развитие и функциональность половых органов.
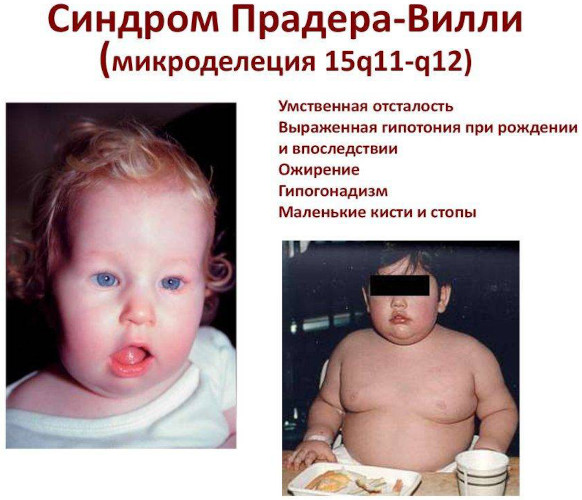
- Синдром Прадера-Вилли. Редкое генетическое расстройство характеризуют выраженные конституционально-анатомические нарушения, угнетение когнитивных способностей и умственной деятельности.
Гипогонадотропный гипогонадизм вторичного происхождения часто сопровождает хроническую дисфункцию простаты, опухолевые изменения в органе. Клинический синдром развивается на фоне везикулита – воспалительного поражения семенных капсул.
Патогенез
Сценарий развития андрогенного дефицита различается для врожденного и приобретенного нарушения. Патогенетические особенности первичного синдрома тестикулярной недостаточности заключаются в аномальной миграции нейронных клеток типа GnRH на стадии эмбрионального развития.
Такие изменения вызывают:
- генные мутации;
- расстройства фактора роста фибропластов;
- нарушения половой дифференциации;
- дефекты молекул внеклеточной адгезии.
Патогенез вторичного клинического синдрома обусловлен недостаточной стимуляцией семенных желез вырабатываемыми гипофизарными тканями гонадотропными веществами из-за акромегалии, кахексии, других патологических процессов.
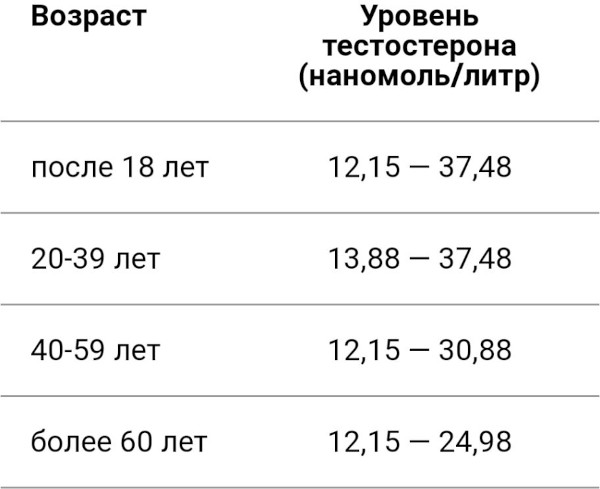
Андрогенную недостаточность подразделяют на относительную и абсолютную в зависимости от установленного методами лабораторной диагностики содержания тестостерона в крови.
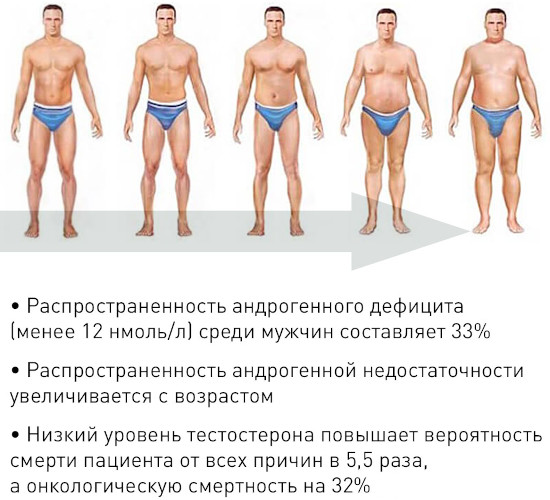
Для последнего варианта характерна концентрация указанного гормона ниже показателя 12 нмоль/л. Отличие относительного андрогенного дефицита заключается в постепенном снижении уровня тестостерона.
По периоду выявления тестикулярной или гипофизарно-гипоталамусной дисфункции заболевание подразделяют на эмбриональное, допубертатное и постпубертатное. В зависимости от выраженности проявлений, типичных признаков различают хроническое и транзиторное расстройство.
Симптоматика и клиническая картина
Определяются возрастом пациента, происхождением и формой андрогенной недостаточности. Симптомы с клиническими проявлениями отличаются существенным разнообразием в зависимости от уровня дефицита тестостерона, спровоцировавших состояние факторов.
Нарушенная в период внутриутробного развития секреторная функция гонад способна привести к формированию двуполых наружных генитальных признаков.
Допубертатное расстройство внешне проявляется:
- задержкой гендерного развития;
- непропорциональным анатомическим строением тела;
- аномально высоким ростом;
- запоздалым окостенением эпифизарных сегментов скелета;
- слаборазвитой грудной клеткой;
- мышечной дистрофией.
Для вторичного заболевания характерно ожирение женского типа, гинекомастия, малое или отсутствующее оволосение лобковой зоны. Наблюдаются снижение либидо и объема эякулята, ухудшение эректильной функции.
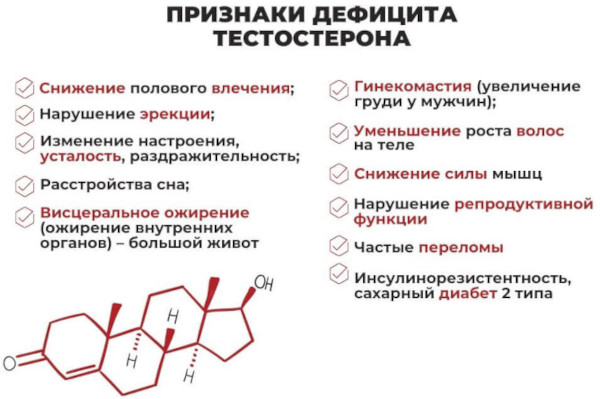
При развитии андрогенной недостаточности у взрослых мужчин развиваются:
- диффузная, очаговая или тотальная алопеция в зависимости от уровня дефицита тестостерона;
- истончение, потемнение, дряблость кожного покрова;
- резкое похудение;
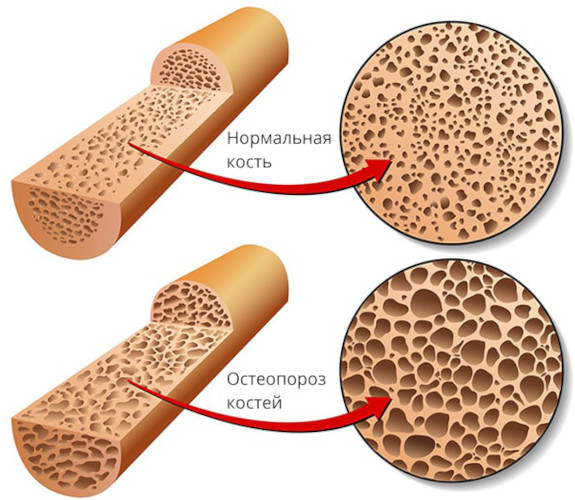
- остеопороз – снижение минеральной плотности костных тканей;
- перманентная утомленность;
- снижение работоспособности;
- стремительное нарастание объема жировых отложений в области поясницы, брюшной поверхности, бедер и ягодиц;
- психоэмоциональная лабильность;
- частые депрессивные проявления;
- раздражительность;
- бессонница.
Клиническая картина приобретенного нарушения содержит сердечно-сосудистый, неврологический, нефротический компоненты. Возникает дисфункция надпочечниковой коры, гепатобилиарного механизма, пищеварительного тракта.
Методы диагностики
Заболевание имеет характерные внешние признаки. Диагностический поиск сводится к определению уровня дефицита тестостерона, степени угнетения функций внутренних органов, корректируемых факторов патологического состояния.
Гипогонадизм требует проведения лабораторных тестов крови и мочевой жидкости. Клиническую картину гипогонадотропного синдрома уточняют с помощью инструментальных методов диагностики.
Осмотр и сбор анамнеза
Визит к антропологу или эндокринологу предусматривает проведение первичного физикального обследования. Профильный специалист анализирует имеющиеся анамнестические сведения, оценивает анатомические параметры тела пациента.
При андрогенной недостаточности выполняют пальпацию тестикул для изучения размера и консистенции семенных желез. Особое внимание в ходе физикального обследования врач уделяет указанным выше внешним признакам заболевания.
Обнаруживается размягченное состояние тестикул, спровоцированное отсутствием стимулирующего влияния гипофизарных гормонов. Для оценки размера гонад используют специальное приспособление – орхидометр Прадера.

При андрогенной недостаточности условный объем семенных желез меньше 12 мл. Для приобретенного после окончания пубертатного периода клинического синдрома нехарактерна инволюция половых органов.
УЗИ предстательной железы, мошонки
Сканирование акустическими волнами считается стандартным и высокоинформативным инструментальным исследованием. УЗИ обеспечивает четкую визуализацию указанных органов урогенитального аппарата.
Эхографическое обследование выполняют трансабдоминальным или трансректальным способом. Последний более информативен. Трансректальный метод применяется как для постановки окончательного диагноза, так и с целью динамического мониторинга. Стоимость процедуры – 2390 руб.
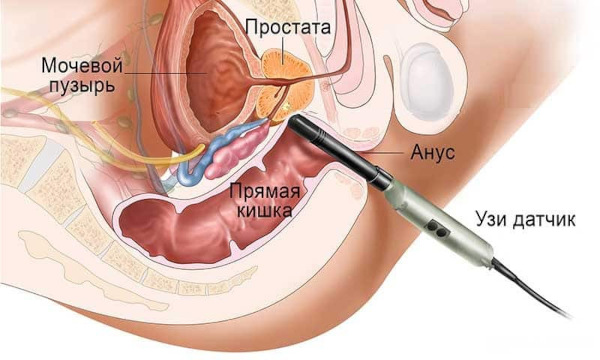
УЗИ предназначено для обнаружения ассоциированных с андрогенной недостаточностью функциональных нарушений и анатомических изменений:
- воспаления;
- склеротических процессов;
- гипоплазий;
- обтурации семенных протоков;
- жидкостного застоя;
- кистозных образований;
- опухолей.
Данные эхографического обследования имеют описательный характер и должны быть подкреплены результатами других методов диагностики. Процедура позволяет оценить анатомическое строение паренхиматозной оболочки предстательной железы, обнаружить морфологические и функциональные изменения в мошонке.
Определение костного возраста
Выполняют с использованием рентгенологического сканирования. Применяется для оценки соответствия истинного биологического возраста, степени развития скелетных структур. Методика актуальна только для диагностики врожденного тестостеронового дефицита.
Полученный показатель имеет относительно значение и подлежит сравнению с условной нормой.
Для корректности исследования обязательно учитывают индивидуальные анатомические параметры тела пациента:
- вес;
- рост;
- окружность грудной клетки;
- ширину плечевого пояса;
Костный возраст оценивают по объему запястий, что обусловлено наличием в них наибольшего числа ядер оссификации. Обследование актуально исключительно при обнаружении андрогенной недостаточности в допубертатный период.
Определение костного возраста по степени оссификации лучезапястного сустава позволяет достоверно установить начало процесса полового созревания. О его завершении свидетельствует образование анатомических синостозов – непрерывного смыкания скелетных структур.
На основании такого признака дифференцируют допубертатную форму патологии с постпубертатной. При оценки костного возраста учитывают типичный срок полового созревания и завершения остеогенеза в этнической или расовой группе, к которой принадлежит пациент.
Денситометрия
Методика предназначена для определения минеральной насыщенности костных тканей, обусловливающей плотность скелетных конструкций. Обследование проводят эхографическим или рентгенологическим способом.
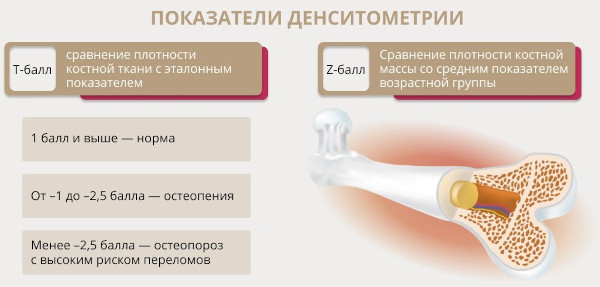
Гипогонадотропный гипогонадизм характеризует низкая оссификация осевого скелета. Оценка представлена в качественно-количественном выражении. Денситометрия – высокочувствительный метод, погрешность которого не превышает 2%. Результаты интерпретируют по специальной Т-шкале и сравнивают с усредненным показателем.
Биопсия яичек
Процедура представляет собой изъятие образца биологических тканей. Биопсия гонад предназначена изучения параметров сперматогенеза, выявления злокачественного опухолевого процесса, установления точной причины обтурации семенных протоков. Манипуляцию выполняют пункционным или скальпельным способом.
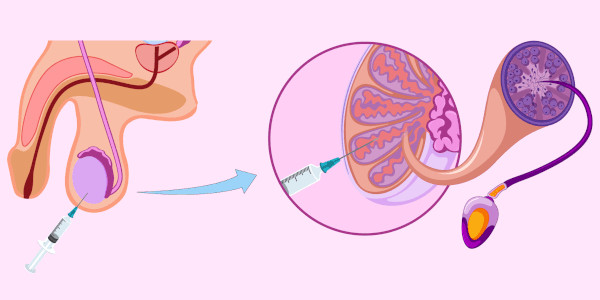
Полученный органический материал исследуют микроскопическим, гистологическим и цитологическим методами. Процедуру выполняют под местным наркозом в рамках комплексной диагностики андрогенной недостаточности. Цена биопсии яичек составляет 850 руб.
Спермограмма
Для заболевания характерно уменьшение объема эякулята по сравнению с возрастным нормативом. При андрогенной недостаточности количество семенной жидкости у пациентов 18-50 лет не превышает 1,5 мл.
Для врожденной формы патологии, обусловленной внутриутробными нарушениями или хромосомными дефектами, типична обструктивная либо секреторная азооспермия. Состояние характеризуется полным отсутствием в семенном секрете сперматозоидов.
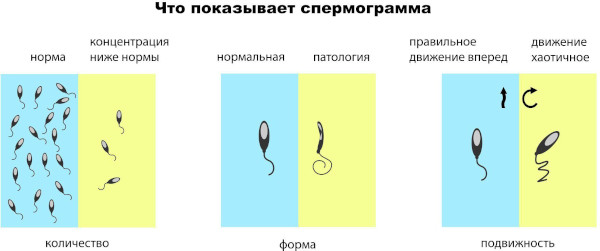
Признак часто сочетается с варикозными деформациями вен гонад, нарушениями кровотока в тканях репродуктивного аппарата. Спермограмма с морфологическим исследованием семенной жидкости МАР-тестированием стоит 4100 руб.
Хромосомные анализы
Такие исследования назначают при подозрении на спровоцировавшее андрогенную недостаточность присутствие в мужском кариотипе дополнительных женских генетических элементов.
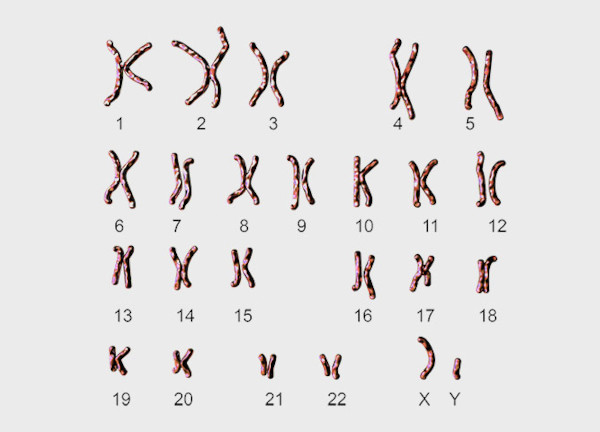
Хромосомное исследование выявляет в слизистом покрытии дентальных тканей тельца Бара – плотно свернутые структурные компоненты, служащие специфическим маркером нарушения. Такие тесты считаются достоверным способом обнаружения генетических дефектов.
Анализы крови на содержание половых и гонадотропных гормонов
Исследование предназначено для определения концентрации в крови соответствующих веществ.
В комплекс лабораторной диагностики при андрогенной недостаточности стандартно включают анализы на:
- тестостерон;
- связывающие такие соединения глобулиновые белки;
- ингибин;
- лютеинизирующее вещество;
- фолликулостимулирующий гормон;
- липидные компоненты крови.

Гипогонадотропный гипогонадизм отличается отклонением от референсного значения всех указанных биохимических параметров. Важное диагностическое значение имеет хорионический гормон, ответственный за половое развитие, стимулирующий работу семенных желез. Комплексное исследование стоит 5250 руб.
Методы лечения
Терапевтические мероприятия носят исключительно индивидуальный характер в зависимости от возраста пациента, уровня андрогенной недостаточности, наблюдаемой клинической картины. На выбор методов лечения влияет спровоцировавший нарушение фактор.
Заместительная гормональная терапия
Предусматривает восполнение дефицита тестостерона путем применения препаратов, содержащих соответствующее вещество, гонадотропные соединения, андрогенные компоненты.

Используемые лекарственные формы представлены в таблице:
| Форма выпуска | Наименования препаратов |
| Пероральные таблетки | Галотестин, Пропионат тестостерона, Провирон |
| Инъекционные растворы | Небидо, Сустанон, Деластерил |
| Трансдермальные гели | Тестодерм, Андрактим |
| Подкожные тестостероновые импланты | Метандрен, Стриант |
Указанные фармацевтические продукты эффективны при выраженном угнетении секреторной функции семенных желез. В период лечения требуется постоянный контроль прироста гормональных веществ в сывороточной фракции крови.
Хирургическое вмешательство
Оперативное лечение заключается в трансплантации семенных желез. Применяется при анорхизме, гипо- или аплазии. Вмешательство выполняют микрохирургическими методами с сохранением имеющихся либо формированием новых сосудистых связей.
Методика обеспечивает надлежащий уровень гормональной компенсации. При недоразвитости пениса попутно осуществляют корректирующую фаллопластику. Стоимость операции составляет порядка 25 000 руб.
Прогноз
Приобретенный синдром андрогенной недостаточности имеет благоприятный исход.
В случае своевременного применения заместительной гормонотерапии:
- уменьшается андрогенный дефицит;
- возобновляются вторичные гендерные признаки;
- частично или полностью восстанавливается эректильная функция;
- снижается выраженность сопутствующих симптомов – облысения, остеопороза, отставание костного возраста.
Генетически детерминированное нарушение первичного типа коррекции лекарственными или хирургическими способами не поддается. При таком расстройстве возможно незначительно снизить симптоматические проявления пожизненной поддерживающей терапией.
Последствия и осложнения
Андрогенный дефицит приводит к бесплодию, импотенции, чрезмерной хрупкости скелетных конструкций. Распространенным осложнением считается гинекомастия. Грозные последствия – повышенный риск инфаркта миокарда, развитие онкологических процессов в тканях мочеполовой системы.
Пациентам с приобретенным гипогонадотропным синдромом назначают особый рацион с высоким содержанием витамина D, постоянный контроль уровня тестостерона, глюкозы и холестерина в крови. При приобретенном гипогонадизме показано регулярное посещение андролога – каждые 6-12 месяцев после завершения курса лечения.
Видео о гипогонадотропном гипогонадизме у мужчин
Излечим ли гипогонадотропный гипогонадизм у мужчин:
