Полимеразная цепная реакция (ПЦР) – современный лабораторный метод наработки большого количества копий отдельных участков нуклеиновых кислот (ДНК или РНК). ПЦР используется во многих областях биологии и медицины. В медицинской диагностике этот метод используют для определения инфекционных заболеваний.
В молекулярной биологии целью копирования может быть участок ДНК для изучения функции определенного гена или других экспериментов (клонирования генов, введения других генов, определение мутаций). В судебной экспертизе исследуют ДНК для сопоставления генетического материла подозреваемых на месте преступления.
Что представляет собой анализ?
В диагностике заболеваний методом ПЦР выделяют определенный участок ДНК возбудителя инфекции в биологическом материале пациента. Если этот участок обнаруживается, это является прямым доказательством наличия возбудителя в организме пациента.

Методом ПЦР можно также обнаружить изменения в генетическом материале пациента, которые помогают определять врожденные заболевания, изменения в иммунной системе, предрасположенность к различным заболеваниям.
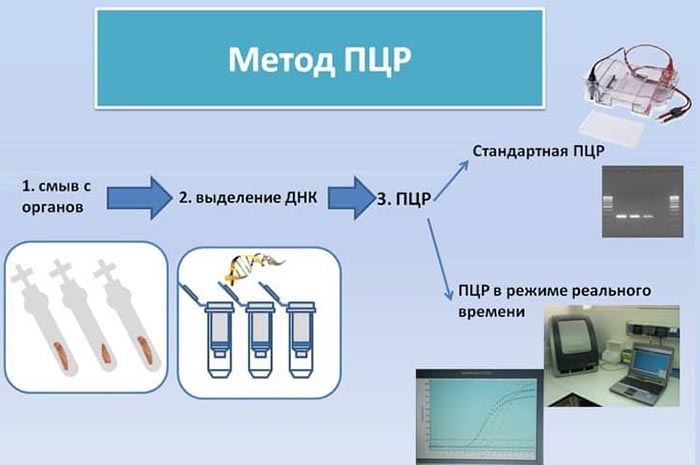
При осуществлении ПЦР анализа определенный участок молекулы ДНК или РНК возбудителя заболевания, содержащийся в биологическом материале, специальными методами выделяют из пробы. Затем этот участок многократно удваивают с помощью ферментов.
Синтезируется такое количество ДНК, которое можно зафиксировать визуально. Копируется только определенный участок молекулы ДНК.
Для проведения ПЦР требуется наличие следующих компонентов:
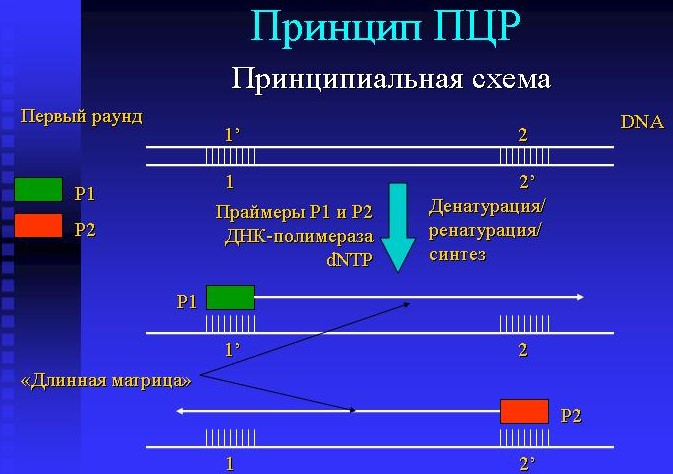
- матрица ДНК (участок ДНК, который многократно копируют и идентифицируют),
- праймеры (специально синтезированные одноцепочечные короткие молекулы ДНК, необходимые для затравки синтеза ДНК),
- ДНК-полимераза (фермент, катализирующий реакцию полимеризации ДНК), дезоксинуклеозидтрифосфаты (азотистые основания – молекулы, из которых состоит ДНК).
- Другие компоненты (ионы магния, буферный раствор).
Полимеразная цепная реакция – это метод, требующий специального оборудования (амплификатора), он состоит из следующих шагов:
- Денатурация ДНК матрицы, при которой двухцепочечная ДНК расщепляется на две нити. Эта стадия протекает в течение 30-40 сек.
- Присоединение праймеров к определенным участкам ДНК происходит в течение 20-60 сек.
- Полимеризация – синтез новых цепей ДНК с помощью фермента.

После многократного повторения этих стадий синтезируется необходимое количество копий (после 20 циклов количество копий достигает более миллиона).
Регистрация ДНК вируса осуществляется после амплификации в специальном приборе (если применяется ПЦР с детекцией в конечной точке) или прямо в амплификаторе во время реакции (если применяется ПЦР в режиме реального времени) флуоресцентным методом.
Где можно сдать, сколько стоит
Сделать ПЦР анализ можно в любой медицинской лаборатории, аккредитованной для проведения этого анализа.
Стоимость теста зависит от вида инфекции:
| Лаборатория | Инфекция/стоимость |
| KDL | ДНК цитомегаловируса – 230 руб.
ДНК вируса герпеса 6 типа – 250 руб. РНК коронавируса SARS-CoV-2/1600 руб. |
| Гемотест | ДНК цитомегаловируса – 250 руб.
ДНК вируса герпеса 6 типа – 240 руб. РНК коронавируса SARS-CoV-2 – 1700 руб. |
| Инвитро | ДНК цитомегаловируса в крови – 400 руб.
ДНК герпес-вируса человека 1 и 2 типа в соскобе эпителиальных клеток кожи – 570 руб. РНК коронавируса SARS-CoV-2 – 1990 руб. |
| Ситилаб | ДНК цитомегаловируса – 240 руб.
ДНК вируса герпеса человека 6 типа – 290 руб. РНК коронавируса SARS-CoV-2 – 1800 руб. |
Разновидности ПЦР
Полимеразная цепная реакция – это метод, для которого разработаны разные способы постановки анализа.
Эти способы были разработаны, чтобы уменьшить риск получения ложноположительных и ложноотрицательных результатов, или для выполнения количественного или качественного анализа, а также для определения разных нуклеиновых кислот: ДНК (дезоксирибонуклеиновой кислоты) или РНК (рибонуклеиновой кислоты).
По методу определения продуктов реакции различают два типа постановки ПЦР:
- ПЦР в режиме реального времени (Real-time PCR) – амплификация и детекция проводятся одновременно в одном приборе. При такой модификации ПЦР возможно определение количества искомой последовательности ДНК на каждом цикле синтеза ДНК.
- ПЦР с детекцией в конечной точке (End-point PCR) – разновидность анализа ПЦР, при которой результаты регистрируются методом флуоресценции в специальном приборе, уже после окончания полимеразной цепной реакции.
В лабораторной практике выделяют разные способы постановки анализа, такие как:
- ПЦР с горячим стартом (hot-start PCR). Особенность этого способа – реакция запускается только по достижению определенной температуры. Компоненты реакции (особенно ферменты) блокируются и начинают работать только при определенном значении температуры. Этот метод повышает точность анализа. Если реакционную смесь нагревать постепенно, то возникает риск образования побочных продуктов реакции и, следовательно, неверных результатов анализа.
- Для детекции вирусов с РНК геномом, например, гепатита С-типа или вируса иммунодефицита человека, используют способ, который называется ПЦР с обратной транскрипцией (ОТ-ПЦР). РНК вируса сначала превращают в комплементарную ДНК молекулу. Затем полученную ДНК используют как матрицу для ПЦР.
- Мультипраймерная ПЦР – способ проведения реакции, при котором одновременно копируются несколько последовательностей ДНК в одной пробе. Данный способ позволяет сократить расходные материалы и уменьшить стоимость анализа.
- Метод ПЦР по технологии NASBA (Nucleic acid sequence based amplification) заключается в том, что в качестве матрицы для копирования генетического материала используется РНК вируса. С помощью специальных ферментов (транскриптаза, РНК-полимераза, РНКаза) в реакционной среде образуется комплементарная ДНК (кДНК), а также комплекс молекул РНК и кДНК. Отличие этой модификации от стандартного ПЦР в том, что в качестве генетического материала накапливается не ДНК, а РНК. Отличие этого метода от метода ОТ-ПЦР, в том, что РНК является не только матрицей для синтеза кДНК, но и продуктом амплификации (то есть конечным продуктом реакции).
Молекулы ДНК разрушаются в организме очень долго и могут быть обнаружены у пациента даже если противовирусная или антибактериальная терапия уже подействовали. Поэтому стандартный метод ПЦР не позволяет оценить эффективность терапии.
В отличие от ДНК молекулы РНК могут быть выделены исключительно из живых клеток или вирусов, а после разрушения живых клеток, молекула РНК также быстро разрушается. Данная модификация позволяет контролировать эффект терапии уже в момент ее проведения.
Достоинства и недостатки ПЦР
По сравнению с другими лабораторными методами обнаружения инфекций метод ПЦР имеет ряд преимуществ:
- Метод ПЦР является прямым методом определения в пробе генетического материала вируса или бактерии. В отличие от других методов, которые определяют косвенные признаки инфекции ПЦР тест прямо указывает на присутствие вируса в организме.
- Высокая специфичность метода, то есть способность выявить определенного возбудителя, связана с тем, что определяется генетический материал, уникальный именно для данного организма (вируса, бактерии, микроскопического гриба). Поэтому специфичность этого метода близка к 100%.
- Высокая чувствительность метода (также близка к 100%) – это количество образца, которое можно определить данным методом. Определяется даже небольшое количество молекул вируса или бактерии в биологическом материале. Это дает возможность выявить носителя вируса еще до появления симптомов.
- Метод универсален для выявления ДНК/РНК любых вирусов или бактерий. С помощью ПЦР можно определять любые инфекции, а также хронические заболевания.
- Быстрый метод анализа, продолжительность – около 4-6 ч.

Недостатки:
- Полимеразная цепная реакция – это метод прямого обнаружения генетического материала возбудителя (ДНК), и он не позволяет оценивать эффективность терапии, так как молекула ДНК не разрушается в течение длительного времени, даже если терапия уже подействовала.
- Высокая чувствительность метода может быть его недостатком. Например, после завершения терапии ПЦР все еще выявляет ДНК погибших клеток у здорового пациента, таким образом получают ложноположительный результат.
- У разных производителей ПЦР тестов одни и те же инфекции могут определяться с помощью разных систем. Поэтому результаты определения одной и той же инфекции в лабораториях могут различаться. Количественные тесты в динамике рекомендуется делать в одной и той же лаборатории.
- Стоимость некоторых анализов, особенно генетических тестов, может быть довольно высокой.
- Для проведения ПЦР тестов необходимо дорогостоящее оборудование, реактивы, а также хорошо обученный квалифицированный персонал. Точность результатов анализа зависит от качества реагентов, способа отбора биологических проб.
Для выявления каких инфекций подходит ПЦР (сферы применения метода в медицине)
Метод ПЦР используется для выявления, то есть качественного определения, а также для количественного определения ДНК и РНК возбудителей разных инфекций:
- вируса иммунодефицита человека (ВИЧ);
- вирусов гепатитов А, В, С, D, G;
- возбудителей, вызывающих заболевания урогенитального тракта, например, Chlamydia trachomatis, Trichomonas vaginalis, Mycoplasma genitalium, Ureaplasma;
- возбудителей, вызывающих дисбиоз урогенитального тракта и кандидозы, например, таких микроорганизмов как Saccharimonas aalborgensis, микроскопических грибов рода Candida;
- возбудителей Папилломавирусных инфекций;
- TORCH и Герпесвирусных инфекций;
- возбудителей природно-очаговых инфекций, которые могут распространяться птицами, животными, кровососущими насекомыми, например, боррелиоз, энцефалит, лихорадка Западного Нила;
- желудочно-кишечные инфекции;
- возбудителей туберкулеза;
- респираторные инфекции (Mycoplasma pneumoniae, Chlamydophila pneumoniae, Haemophilus influenzae, Streptococcus pneumoniae);
- нозокомиальные инфекции (Enterococcus, Acinetobacter baumannii, Klebsiella pneumoniae).

Также методом ПЦР определяется вирусная нагрузка, исследуется динамика заболевания и эффект проводимой терапии.
Полимеразная цепная реакция в медицине имеет другое важное применение – это определение полиморфизмов генов человека (локальных изменений) и мутаций. Незначительные локальные изменения в последовательности ДНК разных генов являются причиной развития различных заболеваний.
Эти заболевания могут передаваться наследственно. Метод ПЦР позволяет выявить эти мутации и предотвратить развитие или облегчить течение заболеваний.
ПЦР используют для выявления мутаций, вызывающих развитие таких заболеваний как:
- нарушение свертываемости крови;
- сердечно-сосудистые заболевания;
- нарушение обмена веществ (например, непереносимость лактозы);
- нарушение репродуктивной функции (мутации, обуславливающие мужское бесплодие);
- рак молочной железы и яичников;
- аутоиммунные заболевания.
Образцы для исследований
В зависимости от типа определяемой инфекции образцами для анализа могут служить образцы биологических жидкостей, тканей, эпителиальных клеток:
- сыворотка/плазма крови, периферическая, пуповинная кровь;
- образцы эпителия слизистых (цервикального канала, влагалища, уретры);
- соскобы конъюнктивы, носовой полости, ротоглотки;
- семенная жидкость, секрет простаты;
- соскоб с эрозивно-язвенных поражений;
- моча;
- мокрота;
- кал;
- другие биологические жидкости (амниотическая, спинномозговая жидкость, околоплодная, суставная жидкости);
- материал биопсии легких, печени, ЖКТ;
- бронхоальвеолярный лаваж.
Правила сдачи биологических жидкостей на ПЦР
Полимеразная цепная реакция – это метод, который требует строгого соблюдения рекомендаций даже на стадии сбора биологического материала.

Неправильный отбор проб может привести к получению ложноположительных или ложноотрицательных результатов.
- Если для транспортировки и хранения биологического материала до анализа необходима специальная транспортная среда, рекомендуется использовать транспортный раствор, произведенный той же фирмой, которая поставляет наборы для ПЦР теста.
- Отбор проб для ПЦР теста производится отдельно от проб, предназначенных для других исследований. Для отбора используются одноразовые стерильные инструменты, емкости и перчатки.
- Рекомендуется отбирать пробы на анализ до начала терапии и через 2 недели после ее окончания.
- Кровь рекомендуется сдавать утром, натощак. Цельную кровь хранят в пробирках с антикоагулянтом (EDTA, натриевая соль лимонной кислоты). Применение других антикоагулянтов, например гепарина, не допускается, так как они ингибируют реакцию ПЦР. Сыворотка крови хранится без антикоагулянта.
- При сборе мочи необходимо собрать утреннюю мочу (первую порцию), около 30-40 мл. Хранить образец до сдачи в лабораторию разрешается не более 2 ч.
- Перед сбором слюны необходимо промыть полости рта физраствором. Рекомендуется не принимать пищу в течение 4 ч перед сбором образца. Количество пробы – от 3 до 5 мл. Слюну отбирают непосредственно перед анализом, материал может храниться замороженным при минус 20 °С.
- Для отбора образцов мокроты используют одноразовые пробирки. Необходимый объем образца от 5 до 10 мл. До анализа допускается хранение образца в течение суток при 4 °С.
- Синовиальная жидкость отбирается с помощью шприца. Для отбора и хранения материала рекомендуется использовать одноразовое стерильное оборудование. Необходимый объем образца – 1 мл.
- Для взятия образца эпителия слизистых оболочек используют зонды (например, из вискозы) или цитощетки.
Как подготовиться к ПЦР-анализу
Правильный сбор материала необходим для получения корректных результатов теста, поэтому рекомендуется соблюдать следующие правила:
- Рекомендуется собирать биологический материал во время острого протекания инфекции, но не следует принимать в это время антибактериальные средства.
- До взятия образцов из влагалища рекомендуется прекратить прием любых влагалищных препаратов, а также не проводить таких процедур как спринцевание в течение суток.
- Перед тем как взять образец из уретры следует 1,5-2 часа воздержаться от мочеиспускания, обработать наружный вход уретры физраствором.
- Образцы мочи рекомендуется собирать натощак, в утреннее время.
- Перед сбором слюны прием пищи, лекарств и алкоголя прекращают за 12 ч до взятия образца. Перед сбором образца ротовую полость и зубы очищают зубной щеткой без пасты, ротовую полость необходимо тщательно прополоскать водой, без использования дополнительных средств. Слюну отбирают шприцем.
- При взятии соскобов из ротоглотки нельзя принимать пищу, пить воду в течение 2 ч. Не рекомендуется использовать спреи для горла, жевательные резинки, леденцы, чистить зубы.
- При сборе мокроты рекомендуется тщательно обработать полость рта: почистить зубы, прополоскать рот. Собирают утренние слизистые или гнойные выделения. Для исследования достаточно 3 мл образца. Для увеличения объема выделений можно принимать отхаркивающие ингаляции или препараты.
- Мазок с конъюнктивы глаза берут на внутренней стороне нижнего века, не касаясь ресниц.
Процедура взятия мазка (у женщин и мужчин)
При исследовании урогенитального тракта у женщин, производится соскоб слизистой влагалища, уретры и цервикального канала. Образцы берут до мануального осмотра. Отбор проб производится с помощью стерильных зондов с тампоном или цитощеткой.
Перед проведением процедуры наружная область уретры обрабатывается стерильным раствором, удаляется избыток слизи из влагалища и шейки матки. Зонд вводится в уретру или в цервикальный канал на глубину 0.5-1.5 см. Материал собирают аккуратными вращательными движениями.
Из влагалища мазок берут с задней стенки. При извлечении зонда не рекомендуется касаться им стенок влагалища.
Зонд (его рабочую область) промывают в пробирке с транспортной жидкостью, которую поставляет производитель набора для ПЦР диагностики, и отжимают о стенки пробирки. Иногда производитель набора рекомендует надламывать зонд и оставлять его рабочую часть прямо в пробирке. Это позволяет уменьшить потери образца.

Не рекомендуется брать мазки на ПЦР после кольпоскопического исследования. Перед забором материала, за 2-3 дня рекомендуется прекратить прием влагалищных таблеток и препаратов. Забор мазка осуществляется не раньше, чем на 2-3 день после окончания менструальных выделений.
При заборе мазка у мужчин наружная область уретры обрабатывается стерильным раствором, избыток выделений удаляется. Стерильный зонд вводится на 3-4 см для взятия образца. Рабочую часть зонда промывают в пробирке с транспортным раствором.
Как расшифровываются анализы на ПЦР
В результаты ПЦР теста кроме названия анализа и результатов теста, указана норма или референсные значения, с которыми можно сравнить полученный результат:
| Название анализа | Результат | Норма |
| ДНК Chlamidia trachomatis | Положительный | Отрицательный |
| ДНК Micoplasma hominis | Отрицательный | Отрицательный |
Положительный результат означает наличие в биологическом материале ДНК патогена, отрицательные результат – его отсутствие.
При оценке вирусной нагрузки проводят количественное определение ДНК. В этом случае таблица результатов содержит числовое значение количества копий обнаруженных ДНК, например:
| Показатель | Результат | Референсные значения |
| Количественное определение ДНК вируса гепатита В | 4.3*10в 3 ст. | <300 клинически не значим; >300 положительный |
В случае качественного и количественного анализа результаты оценивает лечащий врач.
При анализе полученных результатов часто встречаются следующие ошибки:
- Раннее проведение контрольного ПЦР теста после окончания курса антибиотиков (через 1-2 недели). ДНК возбудителя инфекции сохраняется в организме пациента в течение нескольких недель после того, как клетки возбудителя разрушены под действием терапии. Поэтому полученный положительный результат является ложноположительным, а заключение о том, что терапия не подействовала – ошибочно. Если речь идет о возбудителях инфекции на кожном эпителии, то тест рекомендуется проводить не раньше, чем через месяц после окончания лечения.
- При интерпретации ПЦР анализа некоторых инфекций, например цитомегаловирусной инфекции, полученный положительный результат не всегда означает протекание инфекционного процесса и необходимость терапии. Всего в 60% случаев с положительным результатом на ПЦР у пациентов развиваются клинические признаки заболевания.
- При интерпретации ПЦР тестов на вирус папилломы человека положительный тест может быть ошибочно интерпретирован как причина развития онкологических процессов, хотя у 90% пациентов инфекция ВПЧ проходит через 6-24 месяца. При положительном результате нужно проводить исследование эпителия шейки матки, и только после этого оценивать риск развития рака.
- При исследованиях инфекций урогенитального тракта у женщин рекомендуется не только определять условно-патогенные инфекции, но и сравнивать их количество с количеством Lactovacillus, которые считаются главными представителями нормальной микрофлоры влагалища. Такой анализ позволяет определить дисбиоз, правильно интерпретировать результаты ПЦР теста и назначить терапию.
Полимеразная цепная реакция – метод, который используют для количественного исследования вирусной и бактериальной нагрузки. При этом следует учитывать, что для некоторых инфекций нет четкого регламента, позволяющий определить клиническую значимость полученных результатов.
Это означает, что интерпретация результатов субъективна и может быть ошибочна. Так, например, условно-патогенные Ureaplasma, Micoplasma, Gardnerella при отсутствии жалоб и клинических признаков воспаления не требуют назначения терапии. Необоснованное назначение терапии приводит к росту случаев дисбактериоза и вагиноза.
Видео об анализе ПЦР
ПЦР-диагностика вирусной инфекции: объяснение метода:
